الاتزان الأيوني وقانون فعل الكتلة
ما المقصود بالاتزان الأيوني؟
الاتزان الأيوني:هو اتزان ينشأ فى محاليل الإلكتروليتات الضعيفة بين جزيئاتها والأيونات الناتجة عن تفككها
تطبيقات قانون فعل الكتلة على حالات الاتزان الأيونى :
1- المحاليل الإلكتروليتية :
– توجد مواد صلبة متأينة تماماً وعند ذوبانها فى الماء تتفكك إلى أيونات موجبة وسالبة ومحاليلها توصل التيار الكهربى
( مثل كلوريد الصوديوم ) وتسمى المركبات الأيونية وترتبط أيوناتها الموجبة والسالبة بقوى الجذب الإلكتروستاتيكية .
– أما المركبات التساهمية فتكون الروابط بين ذراتها تساهمية مثل غاز كلوريد الهيدروجين الجاف وحمض الهيدروكلوريك النقى ، وفى وجود الماء تتأين هاتان المادتان
– يكون تأين غاز كلوريد الهيدروجين 100 % بينما تأين حمض الخليك يكون محدود جداً
التــــأين : عملية تحول الجزيئات الغير متأينة إلى أيونات
التأين التام : هو تحول كل الجزيئات غير المتأينة إلى أيونات ( يحدث فى الإلكتروليتات القوية )
التأين الضعيف: فيه يتحول جزء ضئيل من الجزيئات غير المتأينة إلى أيونات ( يحدث فى الإلكتروليتات الضعيفة )
ما هو تأثير التخفيف على التوصيل الكهربي؟
تجارب لتوضيح تأثير التخفيف على التوصيل الكهربى:
تجربــــــــة 1
– اختبر التوصيل الكهربى لحمض الخليك النقى
( الثلجى ) وغاز كلوريد الهيدروجين الذائب فى البنزين وذلك باستخدام جهاز كما بالشكل .
المشاهدة :
– المصباح لا يضئ فى كلاً من الحالتين .
الاستنتاج :– كلاً من المحلولين لا يحتوى على أيونات توصل التيار الكهربى .
تجربــــــــة 2
– أذب 0.1 mol من غاز كلوريد الهيدروجين فى لتر ماء وبالمثل أذب 0.1 mol من حمض الخليك ( الأسيتيك ) النقى فى لتر ماء ( للحصول على محلولين متساويين فى التركيز من الحمضين )
2- اختبر التوصيل الكهربى للمحلولين كالموضح بالشكل .
المشاهدة : يضئ المصباح بشدة فى حالة محلول غاز كلوريد الهيدروجين فى الماء ( حمض الهيدروكلوريك ) أما فى حالة حمض الأسيتيك فتكون الإضاءة خافتة .
الاستنتاج : محلول حمض الهيدروكلوريك يحتوى على وفرة من الأيونات ، بينما محلول حمض الخليك يحتوى على نسبة قليلة من الأيونات
تجربــــــــة 3
– خفف المحلولين السابقين بالماء إلى 0.001mol/L – 0.01 mol/Lولاحظ ما يحدث .
المشاهدة : لا تتأثر شدة إضاءة المصباح فى حالة تخفيف محلول حمض الهيدروكلوريك ، بينما تزداد شدة الإضاءة فى حالة تخفيف حمض الخليك
الاستنتاج :
1- المركبات التساهمية : مثل غاز كلوريد الهيدروجين الجاف وحمض الخليك النقى تتأين فى وجود الماء بحيث يكون تأين كلوريد الهيدروجين تاماً ، بينما حمض الخليك يكون تأينه محدوداً جداً .
تفسير ذلك : كلوريد الهيدروجين جيد التوصيل للتيار الكهربى ، حمض الخليك ردئ التوصيل للتيار الكهربى لذلك لا يتأثر تأين حمض الهيدروكلوريك بالتخفيف ، بينما يزداد تأين حمض الخليك بالتخفيف
– يمكن تمثيل تأين كل من الحمضين كما يلى :
–HCl → H+ + Cl
+CH3COOH ↔ CH3COO– + H
– يوجد فى المحلول باستمرار حالتان متعاكستان هما تفكك الجزيئات إلى أيونات واتحاد الأيونات لتكوين جزيئات وبالتالى تنشأ حالة اتزان بين الأيونات وبين الجزيئات الغير متفككة ( الغير متأينة )
ملحوظة
– يمكن تطبيق قانون فعل الكتلة على الإلكتروليتات الضعيفة فقط لأنها غير تامة التأين
– لا يمكن تطبيق قانون فعل الكتلة على الإلكتروليتات القوية لأن محاليلها لا تحتوى على جزيئات غير متفككة فهى تامة التأين
أيون الهيدرونيوم : ( البروتون المماه ) ( +H3O)
– لا يوجد أيون الهيدروجين الناتج من تأين الأحماض فى محاليلها المائية منفرداً فى الماء ولكنه ينجذب إلى زوج الإلكترونات الحر الموجود على ذرة الأكسجين فى أحد جزيئات الماء ويرتبط مع جزئ الماء برابطة تناسقية ( أيون الهيدروجين ( البروتون ) ينتج من تأين الأحماض فى محاليلها المائية .
–HCl + H2O → [H3O+ ] + Cl
قــــــانون استفــــــالد
دور العالم استفالد :إيجاد العلاقة بين درجة التفكك ( a ) والتركيز ( C ) بالمول / لتر للمحاليل أو ( يبين العلاقة الكمية بين درجة التأين ( a ) ودرجة التخفيف )
– نفرض أن لدينا حمض ضعيف أحادى البروتون صيغته الافتراضية HA عند إذابته فى الماء يتفكك عدد من جزيئاته تبعاً للمعادلة :
–HA ↔ H+ + A

حيث [–A ] ، [+H ] ، [HA ] تمثل تركيزات كل من الأيونات الناتجة وجزيئات الحمض غير المتأينة عند حالة الاتزان ، Ka هو ثابت تأين أو تفكك للحمض .
– إذا أذيب مول واحد من الحمض الضعيف HAفى ( V )لتر من المحلول فعند الاتزان تكون :
درجة التفكك = عدد المولات \ عدد المولات الكلية قبل التفكك
– فإذا كان عدد المولات المتفككة ( ∝) مول يكون عدد المولات غير المتفككة من HA = ( ∝ ــ 1 ) مول وعدد مولات كل من –H+ ، A الناتجة =∝ مول
وحيث أن التركيز C = عدد المولات \ الحجم باللتر V
– تكون تركيزات المواد عند الاتزان بالمول لتر هى :

بالتعويض فى معادلة قانون فعل الكتلة فإن :

وتعرف هذه العلاقة بقانون استفالد للتخفيف .
قانون استفالد : عند درجة الحرارة الثابتة تزداد درجة التأين بزيادة التخفيف ( لتظل قيمة ka ثابتة )
– فى حالة الإلكتروليتات الضعيفة فإن درجة التأين a تكون صغيرة بحيث يمكن إهمالها لذلك فإن القيمة ( ∝ ــ 1) يمكن اعتبارها تساوى الواحد تقريباً وتصبح العلاقة :
k a=∝2 / v
وحيث أن تركيز الحمض الضعيف C = 1/v مول / لتر
يمكن كتابة المعادلة السابقة كما يلى :
ka= ∝2 C

ترتيب الأحماض الضعيفة تنازليا حسب ثابت تأينها.
حساب تركيز أيون الهيدرونيوم للأحماض الضعيفة
عندما يتفكك حمض ضعيف مثل حمض الخليك ( تركيزه C ) فى الماء حسب المعادلة :
+CH3COOH ↔ CH3COO– + H3O
[ ∝ ] [ ∝ ] [ ∝ ــ 1]
فإن ثابت التفكك لهذا التفاعل

– من المعادلة السابقة فإن مقدار ما ينتج من أيونات الخلات –CH3COO يساوى مقدار من أيونات الهيدرونيوم +H3O
[+H3O ] = [–CH3COO ]
وبذلك فإن قيمة ثابت الاتزان :

نظراً لأن الحمض ضعيف فإن ما يتفكك منه مقدار ضئيل a يمكن إهماله ومن ذلك فإن تركيز حمض الخليك عند الاتزان( ∝ ــ C) = تركيز حمض الخليك الأصلى C
بالتعويض فى قانون ثابت الاتزان:
![]()

حساب تركيز أيون الهيدروكسيل للقواعد الضعيفة
– القواعد التى تتفكك فى المحلول المائى جزئياً تسمى قواعد ضعيفة .
– يمكن حساب تركيز أيون الهيدروكسيل بنفس طريقة حساب تركيز أيون الهيدرونيوم كما سبق .
مثال : النشادر من القواعد الضعيفة عندما يذاب فى الماء يحدث التفاعل المتزن التالى :
–H2O +NH3 → NH4+ + OH

وتبين معادلة التفكك السابقة تكون مول واحد من كل من أيونى الأمونيوم والهيدروكسيل
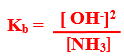
– نظراً لأن ثابت تفكك النشادر صغير فإن جزء قليل جداً منه يتفكك وعند الاتزان فإن تركيز الأمونيا المتبقية [ NH3] يساوى تركيز الأمونيا الأصلية Cb
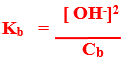
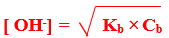
تأين الماء
– الماء النقى إلكتروليت ضعيف لذلك فهو ضعيف التوصيل للتيار الكهربى ومعادلة تأينه هى :
–H2O + H2O ↔ H3O+ + OH
–H2O ↔ H+ + OH ( وللتبسيط تكتب هكذا )
يكون ثابت الاتزان كما يلى :

– وحيث أن مقدار ما يتأين من الماء لا يذكر فإن تركيز الماء غير المتأين يعتبر مقدار ثابت وبعد إهمال تركيز الماء غير المتأين وإدخاله فى ثابت الاتزان تصبح العلاقة الثابتة كما يلى :
Kw = {H+} {OH–} = 10-14
وبما أن الماء متعادل التأثير على عباد الشمس .
-لذا تركيز أيون الهيدروجين المسئول عن الحموضة = تركيز أيون الهيدروكسيل المسئول عن القلوية .
Kw = {10-7} {10-7} = 10-14∴
الحاصل الأيونى للماء (Kw )
حاصل ضرب تركيزى أيونى الهيدروجين والهيدروكسيل الناتجين من تأين الماء ( يساوى 1 × 1014 )
الأس الهيدروجينى ( PH value )
أسلوب للتعبير عن درجة الحموضة أو القاعدية للمحاليل المائية بأرقام متسلسلة تبدأ من صفر إلى 14
أو اللوغاريتم السالب ( للأساس 10 ) لتركيز أيون الهيدروجين
أى = [H+ ] log ــ
[H3O+ ] log ــ = pH ( الحرف p يعنى log ــ )
بالرجوع لمعادلة الحاصل الأيونى للماء وأخذ اللوغاريتم السالب لهذه المعادلة فإنها تصبح :
![]()
باستبدال القيمة ( log ــ ) بالحرف P تصبح المعادلة : 14 = POH + PH = pKw
دلالات قيمة pH:
1-إذا كانت قيمة pH للمحلول أقل من 7 يكون المحلول حامضيا يحمر ورقة عباد الشمس
2- إذا كانت قيمة PH للمحلول تساوى 7 يكون المحلول متعادل ( يظل لون صبغة عباد الشمس بنفسجى )
3- إذا كانت قيمة PH للمحلول أكبر من 7 يكون المحلول قلوى ( يزرق صبغة عباد الشمس )

كلما قلت قيمة PH عن 7 تزداد قوة الحمض وكلما زادت قيمة PH عن 7 تزداد قوة القلوي
– بما أن قيمة kw مقدار ثابت = 14 ، إذن كلما قلت PH تزداد قيمة POH والعكس صحيح

التحلل المائى للأملاح ( التميؤ )
مالمقصود بالتميوء؟
التميؤ : تبادل أيونات الملح والماء لتكوين الحمض والقلوى المشتق منهما الملح
وهو عكس التعادل أى أن :

تقسيم الأحماض والقلويات من حيث القوة والضعف إلى :
1) أحماض قوية ( تامة التأين ) مثل حمض (الهيدروكلوريك ، الكبريتيك ، النيتريك )
2) أحماض ضعيفة مثل حمض ( الأستيك ، الهيدروسيانيك ، الكربونيك )
3) قلويات قوية مثل ( هيدروكسيد البوتاسيوم والصوديوم )
4) قلويات ضعيفة مثل ( هيدروكسيد الأمونيوم )
ملحوظة إذا كان الناتج :
أ- حمض قوى + قلوى قوى ⇐ يكون المحلول متعادل
ب- حمض ضعيف + قلوى ضعيف ⇐ يكون المحلول متعادل
جـ- حمض قوى + قلوى ضعيف ⇐ يكون المحلول حمضى
د- حمض ضعيف + قلوى قوى ⇐ يكون المحلول قلوى
تميؤ ملح كربونات الصوديوم
ملح كربونات الصوديوم هو ملح ( مشتق من حمض ضعيف مع قاعدة قوية )
– عند إذابة كربونات الصوديوم فى الماء يتأين الماء كإلكتروليت ضعيف ويعطى أيونات H+ وأيونات OH– وتتفكك كربونات الصوديوم إلى أيونات صوديوم (+) وأيونات كربونات ( – )

التفسير :
– يلاحظ تكون حمض الكربونيك وأيونات صوديوم وأيونات الهيدروكسيل .
– حيث أن هيدروكسيد الصوديوم إلكتروليت قوى فيكون تام التأين ولا يتكون ويظل تركيز أيونات الهيدروكسيل الناتجة من تأين الماء كما هو .
– أما حمض الكربونيك فيتكون نتيجة اتحاد أيونات الهيدروجين الموجبة الناتجة من تأين الماء مع أيونات الكربونات فى المحلول فيقل تركيز أيونات الهيدروجين فى المحلول .
– ينشأ عن ذلك سحب مستمر لأيونات الهيدروجين الناتج من اتزان تأين الماء وبذلك يختل اتزان الماء .
– لكى يعود تركيز أيون الهيدروجين كما كان فإنه تبعاً لقاعدة لوشاتيليه فإن جزيئات أخرى من الماء تتأين لتعويض النقص فى تركيز أيونات الهيدروجين .
– فيتسبب عن ذلك زيادة فى تركيز أيون –OH ويصبح تركيزها أكبر من تركيز أيونات +H وبذلك يكون الأس الهيدروجينى > 7 ويكون المحلول قلوياً .
تميؤ ملح كلوريد الأمونيوم
ملح مشتق من حمض قوى مع قاعدة ضعيفة

التفسير :
يلاحظ تكون هيدروكسيد الأمونيوم وأيونات الهيدروجين وأيونات الكلور .
– حيث أن حمض الهيدروكلوريك إلكتروليت قوى فيكون تام التأين ولا يتكون ويظل تركيز أيونات الهيدروجين الناتجة من تأين الماء كما هو .
– أما هيدروكسيد الأمونيوم فيتكون نتيجة اتحاد أيونات الهيدروكسيل الناتجة من تأين الماء مع أيونات الأمونيوم الموجبة فى المحلول فيقل تركيز أيونات الهيدروكسيل فى المحلول .
– ينشأ عن ذلك سحب مستمر لأيونات الهيدروكسيل الناتجة من اتزان تأين الماء وبذلك يختل اتزان الماء .
– لكى يعود تركيز أيون الهيدروكسيل كما كان فإنه تبعاً لقاعدة لوشاتيليه فإن جزيئات أخرى من الماء تتأين لتعويض النقص فى تركيز أيونات الهيدروكسيل .
– فيتسبب عن ذلك زيادة فى تركيز أيون +H ويصبح تركيزها أكبر من تركيز أيونات OH – وبذلك يكون الأس الهيدروجينى < 7 ويكون المحلول حمضياً .
تميؤ ملح أسيتات الأمونيوم
هو ملح مشتق من حمض ضعيف مع قاعدة ضعيفة

التفسير :
لا يتكون حمض الهيدروكلوريك القوى ( تام التأين ) ولا هيدروكسيد الصوديوم القلوى القوى ( تام التأين ) لذلك تبقى أيونات الهيدروجين وأيونات الهيدروكسيل كما هى ويصبح المحلول متعادلاً .
حاصــل الإذابة
– يوجد لكل ملح صلب حد معين للذوبان فى الماء عند درجة حرارة معينة وعند الوصول لهذا الحد تصبح المادة المذابة فى حالة اتزان ديناميكى مع المادة غير المذابة ويوصف المحلول حينئذ بالمحلول المشبع
– مدى ذوبانية الأملاح الصلبة فى الماء واسع جداً
أمثلة :ذوبانية نترات البوتاسيوم KNO3 فى الماء تساوى 31.6 g ̸ 100g عند 20°C ، ذوبانية كلوريد الفضة AgCl فى الماء تساوى 0.0016 g ̸ 100g عند نفس الدرجة
مثال : عند إذابة بروميد الرصاص ( شحيح الذوبان ) فى الماء . –PbBr2 ⇒ Pb+2 + 2Br
فإن ثابت الاتزان :

وحيث أن تركيز PbBr2 يظل ثابتاً تقريباً فإن :
2[–Br ] [Pp+2] = Ksp
يسمى Ksp حاصل الإذابة
حاصل الإذابة Ksp : حاصل الإذابة لأى مركب أيونى شحيح الذوبان هو حاصل ضرب تركيز أيوناته ( مقدرة
بالمول / لتر ) والتى توجد فى حالة اتزان مع محلولها المشبع .
تدريب
علل لما يأتي؟
1- لا يتأثر تأين حمض الهيدروكلوريك بالتخفيف بينما يزداد تأين حمض الخليك
لأن حمض الهيدروكلوريك تام التأين ولكن حمض الخليك ضعيف التأين
2- لا يوجد أيون الهيدروجين ( البروتون )منفرداً فى المحاليل المائية للأحماض
لأنه يرتبط مع جزيئات الماء بروابط تناسقية مكوناً أيون الهيدرونيوم .
3- لا يطبق قانون فعل الكتلة على محاليل الإلكتروليتات القوية
لأن محاليل الإلكتروليتات القوية تامة التأين
4- تزداد درجة التأين للحمض الضعيف بزيادة التخفيف ( عند ثبوت درجة الحرارة )
حتى تظل قيمة Ka للحمض ثابتة
5- يستدل على قوة الأحماض من قيمة ثابت تأينها
لأن قوة الحمض تتناسب طردياً مع قيمة ثابت التاين Ka
6- قيمة الرقم الهيدروجينى للماء = 7 ( الماء النقى متعادل التأثير على عبد الشمس )
لأن تركيز أيونات الهيدروجين مساوى لتركيز أيونات الهيدروكسيل .
7- محلول كربونات الصوديوم قلوى التأثير على عباد الشمس
لأنه عند ذوبانها فى الماء تتميأ إلى حمض كربونيك غير تام التأين وهيدروكسيد صوديوم تام التأين فيكون أيون الهيدروكسيل أكبر من تركيز أيون الهيدروجين يصبح < PH 7
8- محلول كلوريد الأمونيوم حمضى التأثير على عباد الشمس
لأنه عند ذوبانه فى الماء يتميأ إلى حمض هيدروكلوريك قوى تام التأين وهيدروكسيد أمونيوم ضعيف فيكون تركيز أيون الهيدروجين أكبر من تركيز أيون الهيدروكسيد ويصبح PH< 7
9- محلول كلوريد الصوديوم متعادل التأثير على عباد الشمس
لأنه عند ذوبانه فى الماء يتميأ إلى حمض هيدروكلوريك تام التأين وصودا كاوية تام التأين فيتساوى تركيز أيون الهيدروجين مع تركيز أيون الهيدروكسيد ويصبح = PH 7
10- لا يتكون حمض الهيدروكلوريك وهيدروكسيد الصوديوم عند إذابة ملح الطعام فى الماء بينما يتكون حمض الأسيتيك وهيدروكسيد الأمونيوم عند إذابة أسيتات الأمونيوم فى الماء
لأن حمض الهيدروكلوريك وهيدروكسيد الصوديوم من المواد تامة التأين بينما حمض الأسيتيك وهيدروكسيد الأمونيوم من المواد غير تامة التأين
