الاتزان الكيميائي التفاعلات التامة والتفاعلات غير التامة
مفهوم الاتزان الكيميائي
باجراء التجربة التالية يمكن استنتاج والاجابة على مفهوم الاتزان الكيميائي
– نضع كمية من الماء فى إناء مغلق على موقد
2- نلاحظ حدوث عمليتين متضادتين ومتعاكستين هما عملية التبخير وعملية التكثيف .
3- فى بداية التسخين يكون معدل تبخير الماء هى العملية السائدة ويصحبها زيادة فى الضغط البخارى
4- تستمر عملية التبخير يتساوى الضغط البخارى مع ضغط بخار الماء المشبع
5- تحدث حالة اتزان بين سرعة التبخير وسرعة التكثيف ويكون عندها عدد جزيئات الماء التى تتبخر مساوياً لعدد جزيئات البخار التى تتكثف .
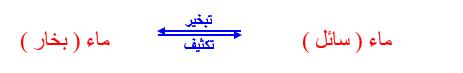
يلاحظ مما سبق أنه كما يحدث اتزان فى الأنظمة الفيزيائية يحدث اتزان فى العديد من التفاعلات الكيميائية .
الضغط البخارى :
ضغط بخار الماء الموجود فى الهواء عند درجة حرارة معينة
ضغط بخار الماء المشبع :
أقصى ضغط لبخار الماء يمكن أن يتواجد فى الهواء عند درجة حرارة معينة
النظام المتزن :
نظام ساكن على المستوى المرئى و ديناميكى على المستوى غير المرئى
تقسيم التفاعلات الكيميائية حسب الاتزان :
أ- تفاعلات تامة (تفاعلات غير إنعكاسية)
ب – تفعلات غير تامة (إنعكاسية)
أ- التفاعلات التامة (غير انعكاسية):
تفاعلات تحدث فى إتجاه واحد بحيث لا تستطيع المواد الناتجة أن تتحد مع بعضها مرة أخرى لتكوين المواد المتفاعلة تحت ظروف التجربة ( لخروج أحد النواتج من حيز التفاعل على هيئة غاز أو راسب )
أمثلة :
1- عند وضع شريط من الماغنسيوم فى محلول حمض هيدروكلوريك يتصاعد غاز الهيدروجين

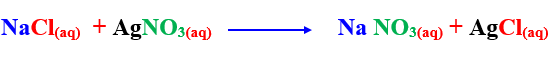
2– عند إضافة محلول كلوريد الصوديوم إلى محلول نترات الفضة يتكون راسب أبيض من كلوريد الفضة
اولا:التفاعلات غير التامة ( الانعكاسية )
التفاعلات غير التامة ( انعكاسية ) : تفاعلات تحدث فى الاتجاهين الطردى والعكسى ( المواد المتفاعلة والناتجة من التفاعل تكون موجودة باستمرار فى حيز التفاعل )
مثال : – عند إضافة مول من حمض الخليك إلى مول من الكحول الإيثيلى فإنه من المتوقع أن يتكون مول من الإستر
( أسيتات الإيثيل ) ومول من الماء ( هذه المواد متعادلة التأثير على عباد الشمس )

– ولكن عند اختبار محلول التفاعل بورقة عباد الشمس الزرقاء نجد أنها تحمر
التفسير : هذا التفاعل ليس من التفاعلات المنتهية التى تسير فى اتجاه تكوين النواتج فقط وبالتالى تكون المتفاعلات والنواتج موجودة باستمرار فى حيز التفاعل وهذا يفسر حموضة التفاعل نتيجة لوجود حمض الخليك
الاتزان الكيميائى فى التفاعلات الانعكاسية
هو نظام ديناميكى يحدث عندما يتساوى معدل التفاعل الطردى مع معدل التفاعل العكسى وتثبت تركيزات المتفاعلات والنواتج ، ويظل الاتزان قائماً طالما كانت جميع المواد المتفاعلة والناتجة موجودة فى وسط التفاعل ( لم يتصاعد غاز ولم يتكون راسب ) ومادامت ظروف التفاعل مثل درجة الحرارة أو الضغط ثابتة .
معدل التفاعل الكيميائي:
1- التركيز يقاس بالمول / لتر
2- الزمن يقاس بالثوانى أو بالدقائق
3- معدل التفاعل يرمز له بالرمز ( r )
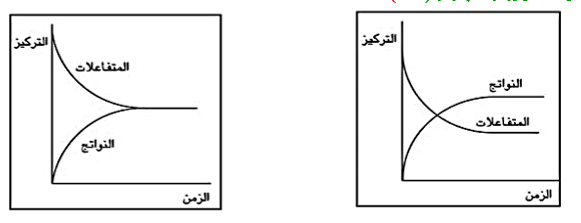
1- سرعة التفاعل فى حالة التفاعلات التامة
– نلاحظ أنه اثناء حدوث التفاعل الكيميائى التام يقل تركيز المواد المتفاعلة ويزداد تركيز المواد الناتجة من التفاعل إلى أن ينتهى التفاعل بزيادة الزمن
2- سرعة التفاعل فى حالة التفاعلات الانعكاسية
– يقل تركيز المواد المتفاعلة تدريجياً ويزداد تركيز المواد الناتجة حتى يصلا إلى حالة الاتزان عند تساوى سرعة التفاعل الطردى مع سرعة التفاعل العكسى مهما زاد الزمن فى حالة عدم وجود عوامل مؤثرة خارجية .
تقسيم التفاعلات الكيميائية حسب سرعتها:
تفاعلات لحظية:
تفاعلات تنتهى فى وقت قصير مثل تفاعل نترات الفضة مع كلوريد الصوديوم ، لتكوين راسب أبيض من كلوريد الفضة بمجرد خلط المواد المتفاعلة
تفاعلات بطيئة نسبياً:
تفاعل التصبن و هو تفاعل الزيوت مع الصودا الكاوية لتكوين الصابون و الجلسرين
تفاعلات بطيئة جداً:
يتطلب حدوثها شهوراً عديدة مثل تفاعل تكوين صدأ الحديد
العوامل التى تؤثر على معدل ( سرعة ) التفاعل الكيميائى
1) طبيعة المواد المتفاعلة
تنقسم إلى عاملان مهمان هما :
أ- نوع الترابط فى جزيئات المواد المتفاعلة :
– إذا كانت المواد المتفاعلة أيونية ( مثل تفاعل كلوريد الصوديوم مع نترات الفضة ) فإن تفاعلاتها تكون لحظية وسريعة جداً لأن أيونات المواد المتفاعلة تتفاعل بسرعة بمجرد خلطها
– أما إذا كانت المواد المتفاعلة تساهمية ( مثل المركبات العضوية ) تكون تفاعلاتها بطيئة
ب– مساحة السطح المعرض للتفاعل :
تجربــة :
1- ضع كتلتين متساويتين من الخارصين فى أنبوبتى اختبار أحدهما على هيئة مسحوق والآخر كتلة واحدة
2- أضف إلى كل أنبوبة حجماً متساوياً من حمض الهيدروكلوريك
المشاهدة : نجد أن التفاعل فى حالة المسحوق يكون أسرع من التفاعل فى حالة الكتلة الواحدة .
الاستنتاج : كلما زادت مساحة السطح المعرض للتفاعل بين المواد المتفاعلة كلما كان معدل التفاعل أسرع .
لذا يفضل استخدام النيكل المجزأ عن قطع النيكل فى عملية هدرجة المواد العضوية والزيوت لزيادة مساحة السطح المعرض للتفاعل فى حالة
2) تأثير تركيز المواد المتفاعلة على معدل التفاعل
– التفاعل الكيميائى يحدث نتيجة تصادم الجزيئات المتفاعلة مع بعضها .
– كلما زاد عدد الجزيئات المتفاعلة ( تركيز المواد المتفاعلة ) كلما زادت فرص التصادم وبالتالى زادت سرعة التفاعل .
– العالمان النرويجيان ( جولدبرج وفاج ) وضعا القانون الذى يعبر عن العلاقة بين سرعة التفاعل الكيميائى وتركيز المواد المتفاعلة ويسمى قانون فعل الكتلة
قانون فعل الكتلة :
عند ثبوت درجة الحرارة تتناسب سرعة التفاعل الكيميائى تناسباً طردياً مع حاصل ضرب التركيزات الجزيئية لمواد التفاعل ( كل مرفوع لأس يساوى عدد مولات الجزيئات والأيونات فى معادلة التفاعل الموزونة )
تجربة لتوضيح قانون فعل الكتلة :
1- أضف محلول كلوريد الحديد III ( أصفر باهت ) إلى محلول ثيوسيانات الأمونيوم ( عديم اللون ) بالتدريج حتى يصبح لون الخليط أحمر دموى
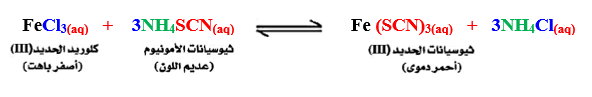
2- عند إضافة مزيد من كلوريد الحديد III نجد أن لون المحلول يزداد احمراراً مما يدل على تكون مزيد من ثيوسيانات الحديد III الأحمر
الاستنتاج : عند زيادة تركيز أحد المواد الداخلة فى الاتزان والموجودة فى أحد طرفى المعادلة ينتج عنه إزاحة ( توجيه ) التفاعل إلى الطرف الآخر .
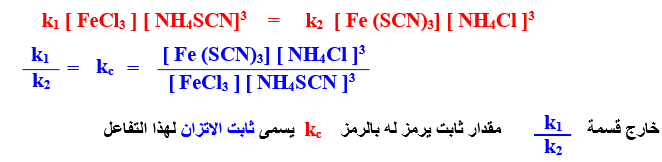
3-عندما يتساوى معدل التفاعل الطردى ( r1 ) والعكسى ( r2 ) فى التفاعل السابق فإن التفاعل يكون قد وصل إلى حالة اتزان ، ويعبر عن كلا المعدلين للتفاعل الآتى :
3[ NH4SCN ] [ FeCl3 ] r1 α
3[ NH4SCN ] [ FeCl3 ]r1 = k1
3[ NH4Cl] [Fe ( SCN )3 ] r2 α
3[NH4Cl] [ Fe ( SCN )3] =r2 = k2
– عند الاتزان يتساوى معدل التفاعلين r2 = r1 ويكون :
ملاحظات
1- الأقواس المستطيلة [ ] تدل على التركيزات بوحدات Mol / L
2-( k2 ، k1 ) فهما ثابتا معدل التفاعل الطردى والعكسى على الترتيب
3-القيم الصغيرة لثابت الاتزان Kc < 1 تعنى أن تركيز النواتج ( فى البسط ) أقل من تركيز المواد المتفاعلة ( فى المقام ) مما يعنى أن التفاعل لا يسير بشكل جيد نحو تكوين النواتج وأن التفاعل العكسى له دور فعال ( سائد )
مثال : ذوبان كلوريد الفضة فى الماء
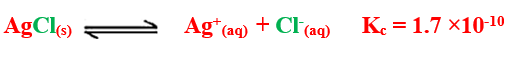
– قيمة Kc فى التفاعل السابق تدل على عدم قابلية كلوريد الفضة للذوبان فى الماء
5- القيم الكبيرة لثابت الاتزان Kc > 1 تعنى أن التفاعل يستمر إلى قرب نهايته أى أن التفاعل الطردى هو السائد
مثال : تفاعل الكلور مع الهيدروجين

6-إذا كانت القيمة العددية لثابت الاتزان تساوى واحد صحيح أو تقترب منه قليلاً ، لا يكون أى من التفاعلين سائد على الآخر .
7-لا يكتب تركيز الماء النقى كمذيب أو المواد الصلبة أو الرواسب فى معادلة حساب ثابت الاتزان حيث أنها تعتبر ذات تركيز ثابت بوجه عام مهما اختلفت كميتها لأن قيمتها لا تتغير بدرجة ملموسة .
8-القيمة العددية لثابت الاتزان لا تتغير بتغير تركيز المواد المتفاعلة أو الناتجة عند نفس درجة الحرارة
3- تأثير درجة الحرارة على سرعة التفاعل الكيميائي
– سرعة التفاعل الكيميائى تزداد عند رفع درجة الحرارة ، كثير من التفاعلات تتضاعف سرعتها عند رفع درجة الحرارة للضعف
التفسير :تفترض نظرية التصادم أنه لحدوث التفاعل يشترط أن تصطدم جزيئات المواد المتفاعلة بحيث تكون الجزيئات المتصادمة ذات السرعات العالية جداً فقط هى التى تتفاعل لأن طاقتها الحركية العالية تمكنها من كسر الروابط بين الجزيئات فيحدث التفاعل .
– لذلك لابد أن يمتلك الجزئ حد أدنى من الطاقة الحركية لكى يتفاعل عند الاصطدام يسمى طاقة التنشـيـط
طاقة التنشيط :
الحد الأدنى من الطاقة التى يجب أن يمتلكها الجزئ لكى يتفاعل عند الاصطدام
ملاحظة:
– الجزيئات المنشطة : الجزيئات ذات الطاقة الحركية المساوية لطاقة التنشيط أو تفوقها
2- كلما زادت درجة الحرارة زادت نسبة الجزيئات المنشطة وزادت فرص التصادم فتزداد سرعة التفاعل
تجربة لتوضيح تأثير درجة الحرارة على سرعة تفاعل متزن

الخطوات :
1- أحضر دورق به غـاز ثانى أكسيد النيتروجين ( بنى محمـر ) وضعه فى إناء به مخلوط مبرد نجد أن اللون يخف تدريجياً حتى يزول .
2- أخرج الدورق ثم اتركه تعود إلى درجـة حـرارة الغرفة نلاحظ أن اللون البنى المحمر يبدأ فى الظهور ثم يعود إلى ما كان عليه وتزداد درجة اللون كلما ارتفعت درجة الحرارة .
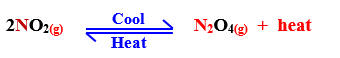
الاستنتاج :
1- خفض درجة الحرارة فى تفاعل طارد للحرارة يجعل التفاعل يسير فى الاتجاه الطردى .
2- رفع درجة الحرارة فى تفاعل طارد للحرارة يجعل التفاعل يسير فى الاتجاه العكسى .
– ويحدث عكس ذلك فى التفاعلات الماصة للحرارة .
ملاحظات مهمة:
تنقسم التفاعلات الكيميائية حسب التغير الحرارى المصاحب لحدوثها إلى:
أ – تفاعلات طاردة للحرارة ومعادلة التفاعل يعبر عنها بأحد الصور الآتية:
(حرارة ، طاقة ) A + B → AB + Heat Energy
A + B → AB , ∆ H = (-) K. J
C + D – Heat Energy → C D
ب – تفاعلات ماصة للحرارة ومعادلة التفاعل يعبر عنها بأحد الصور الآتية
(حرارة ، طاقة )C + D → C D – Heat ، Energy
C + D → C D , ∆ H = (+) K. J
C + D + Heat Energy → C D
جـ- فى حالة التفاعلات الطاردة للحرارة كما فى التفاعل المتزن الآتى
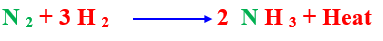
أ ) عند رفع درجة الحرارة ينشط التفاعل بسرعة أكبر فى الاتجاه العكسى .
ب) عند خفض درجة الحرارة ينشط التفاعل بسرعة أكبر فى الاتجاه الطردى .
– أى عند تبريد النشادر المتكون باستمرار ينشط التفاعل فى اتجاه تكوين مزيد من النشادر .
د- فى حالة التفاعلات الماصة للحرارة كما فى التفاعل المتزن الآتى :

أ- عند رفع درجة الحرارة ينشط التفاعل بسرعة أكبر فى الاتجاه الطردى
ب- عند خفض درجة الحرارة ينشط التفاعل بسرعة أكبر فى الاتجاه العكسى
– أى عند رفع درجة الحرارة فى التفاعل المتزن السابق تزداد سرعة تكون NO
4- تأثير الضغط على سرعة التفاعل الكيميائي
–تركيز المواد فى المحاليل يعبر عنها عادة بالمولارية ، ويتم التعبير عنها بوضع المادة بين قوسين مربعين [ ]
– أما إذا كانت المواد الداخلة فى التفاعل أو الناتجة منه فى الحالة الغازية فإن التعبير عن التركيز يتم عادة باستخدام ضغطها الجزئى .
مثال : النشادر يحضر فى الصناعة من عنصريه كما يلى:
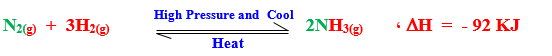
– يلاحظ من التفاعل أن 4 mol من الجزيئات تتفاعل لينتج 2 mol من جزيئات النشادر أى أن تكوين النشادر يكون مصحوباً بنقص فى عدد المولات ، وبالتالى ينقص الحجم
– بالضغط والتبريد يزداد معدل تكوين النشادر
إذن زيادة الضغط على تفاعل غازى متزن تجعله ينشط فى الاتجاه الذى يقل فيه الحجم .
-يعبر عن ثابت الاتزان فى هذه الحالة بالرمز kp للدلالة على تركيز المواد معبراً عنه بالضغط الجزيئى .
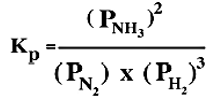
ملحوظة كما فى kc نجد أن kp للتفاعل لا تتغير بتغير الضغوط الجزئية للغازات المتفاعلة أو الناتجة فى نفس درجة الحرارة ويكون الضغط الكلى للتفاعل هو مجموع الضغوط الجزئية لغازاته ( والمرتبطة بعدد مولات كل غاز )
كما يمكن التعبير عن ثابت الاتزان أيضاً بدلالة التركيز المولارى
من المشاهدات السابقة استطاع العالم لوشاتيليه أن يضع قاعدة بإسمه تسمى قاعدة لوشاتيليه
قاعدة لوشاتيليه :
إذا حدث تغير فى أحد العوامل المؤثرة على نظام فى حالة اتزان مثل ( التركيز ، الضغط ، درجة الحرارة ) فإن النظام ينشط فى الاتجاه الذى يقلل أو يلغى تأثير هذا التغير
دور العالم لوشاتيليه : وضع قاعدة تصف تأثير العوامل المختلفة مثل التركيز والضغط ودرجة الحرارة على الأنظمة المتزنة
5- تأثير العوامل الحفازة على معدل التفاعل
ما هو العامل الحفاز ؟
العامل الحفاز :
مادة يلزم القليل منها لتغيير معدل التفاعل الكيميائى دون أن تتغير أو تغير من موضع الاتزان
– الحفازات هى عناصر فلزية أو أكاسيدها أو مركباتها أو إنزيمات
دور العامل الحفاز : يقوم العامل الحفاز بتقليل طاقة التنشيط اللازمة للتفاعل ( يسرع التفاعل الطردى والعكسى )
– باستخدام العوامل الحفازة يمكن إسراع معظم التفاعلات البطيئة دون الحاجة إلى زيادة درجة الحرارة
تستخدم العوامل الحفازة فى حوالى 90 ٪ من العمليات الصناعية مثل :
1- صناعة الأسمدة والبتروكيماويات والأغذية .
2- توضع فى المحولات المستخدمة فى شكمانات السيارات لتحويل غازات الاحتراق الملوثة للجو إلى نواتج آمنة .
الإنزيمات : هى جزيئات من البروتين تتكون فى الخلايا الحية .
وظيفة الإنزيمات : تعمل كعوامل حفز فى العديد من العمليات البيولوجية والصناعية .
6- تأثير الضوء على معدل التفاعل الكيميائي
بعض التفاعلات الكيميائية تتأثر بالضوء ومثال ذلك :
1- التمثيل الضوئى : حيث يقوم الكلوروفيل فى النباتات الخضراء بامتصاص الضوء وتكوين الكربوهيدرات فى وجود ثانى أكسيد الكربون والماء .
2- أفلام التصوير : التى تحتوى على بروميد الفضة فى طبقة جيلاتينية وعندما يسقط الضوء عليها فإنه يعمل على اكتساب أيون الفضة الموجب لإلكترون من أيون البروميد السالب ليتحول إلى فلز الفضة أما البروم المتكون فإنه يمتص فى الطبقة الجيلاتينية ، وكلما زادت شدة الضوء زادت كمية الفضة المتكونة
Ag+ + e → Ag
تدريبات
علل :
1- تفاعل الماغنسيوم مع حمض الهيدروكلوريك المخفف تفاعل تام
-لخروج أحد النواتج من حيز التفاعل كغاز يتصاعد ( H2)
2- المركبات الأيونية تفاعلاتها سريعة بينما المركبات التساهمية بطيئة نسبيا ً
لأن التفاعل فى حالة المركبات الأيونية يتم بين الأيونات وفى حالة المركبات التساهمية يتم التفاعل بين الجزيئات
3- يستخدم النيكل المجزأ وليست قطع النيكل فى هدرجة الزيوت النباتية
بسبب زيادة مساحة السطح المعرض للتفاعل
4- احمرار ورقة عباد الشمس الزرقاء عند وضعها فى إناء يحتوى على حمض الخليك و الكحول الإيثيلى بالرغم من أن الإستر الناتج متعادل
لوجود حمض الخليك دائماً فى حيز التفاعل
5- لا يكتب تركيز الماء أو المواد الصلبة عند حساب ثابت الاتزان
لأن تركيزها ثابت مهما اختلفت كميتها
6- صعوبة ذوبان كلوريد الفضة فى الماء حسب المعادلة
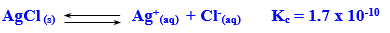
لأن قيمة ثابت الاتزان للتفاعل صغيرة جداً مما يعنى أن التفاعل العكسى هو السائد
7- صعوبة انحلال كلوريد الهيدروجين الى عناصره حسب المعادلة

لأن قيمة ثابت الاتزان للتفاعل كبيرة جداً مما يعنى أن التفاعل الطردى هو السائد
8- تزداد سرعة التفاعل الكيميائى بارتفاع درجة الحرارة
لأن رفع درجة الحرارة يؤدى إلى زيادة طاقة حركة الجزيئات فيزداد عدد الجزيئات المنشطة ، كما يؤدى إلى زيادة فرص التصادم بين الجزيئات المنشطة وبالتالى يزداد معدل التفاعل .
9- سرعة فساد الأطعمة فى فصل الصيف
لأن زيادة درجة الحرارة تعمل على زيادة معدل التفاعلات التى تسبب تحلل الأطعمة وفسادها .
10- تحفظ المواد الغذائية صيفا فى الثلاجات
لأن انخفاض درجة الحرارة يبطئ من سرعة التفاعلات التى تحدث فى الأطعمة وتسبب تحللها وفسادها
11- تستخدم أوانى الضغط ( البرستو ) فى طهى الطعام
بسبب زيادة ضغط البخار بداخلها مما يؤدى إلى ارتفاع درجة الحرارة فتزداد سرعة التفاعلات اللازمة لطهى الطعام .
12- بالرغم من أن تفاعل تحضير النشادر فى الصناعة طارد للحرارة إلا أنه لا يبدأ إلا بالتسخين
حتى تكتسب الجزيئات طاقة التنشيط اللازمة لبدء التفاعل
13- لا يؤثر العامل الحفاز على ثابت الاتزان فى التفاعل الانعكاسى
لأنه يعمل على زيادة معدل التفاعل فى الاتجاه الطردى والعكسى بنفس المعدل .
14- زيادة كمية النشادر المحضر صناعيا بالضغط والتبريد
لأنه طبقاً للمعادلة
( N2 + 3H2↔ 2NH3 – ΔH )
( حيث أن التفاعل طارد للحرارة ومصحوباً بنقص فى حجوم الغازات فإن خفض درجة الحراة ورفع الضغط يسير التفاعل فى الاتجاه الطردى ( اتجاه تكوين غاز النشادر )
