التحليل الكمى الوزنى الكتلى الكيميائي
التحليل الكمي الوزني الكتلي الكيميائي
هو طريقة تعتمد على فصل المكون المراد تقديره ثم تعيين كتلته وباستخدام الحساب الكيميائي يمكن معرفة كميته ويتم فصل المركب بإحدي الطريقتين :
ما هي طرق فضل المكونات ؟
أ-طريقة التطاير ب- طريقة الترسيب
طريقة التطاير :
تعتمد طريقة التطاير على أساس تطاير العنصر أو المركب المراد تقديره
وتجرى عملية التقدير إما بجمع المادة المتطايرة وتعيين كتلتها أو بتعيين النقص فى كتلة المادة الأصلية قبل وبعد التسخين .
مثال:
إذا كانت كتلة عينة من كلوريد الباريوم المتهدرت BaCl2 .xH2O تساوى 2,6903 جم
و سخنت تسخيناً شديداً إلى أن ثبتت كتلتها فوجدت 2,2923 ، إوجد عدد مولات جزيئات ماء التبلر
و صيغته الجزيئية ثم إحسب النسبة المئوية لماء التبلر .
( O = 16 , H = 1 , Cl = 35.5 , Ba = 137 )
الحل:
كتلة المادة المتهدرت = 2,6903جم .
الكتلة الجافة = 2,2923 جم
كتلة ماء التبلر = 2,6903 – 2,2923 = 0,398 جم
الكتلة الجزيئية BaCl2 = ( 1 × 137 ) +( 2× 35,5 ) = 208 جم
|
عدد مولات جزيئات الماء فى الصيغة = |
0,398× 208 |
= 2 مول جزي. |
|
2,2923× 18 |
الصيغة الجزيئية هى BaCl2.2H2O
|
نسبة ماء التبلر = |
0,398 × 100 |
= 14,79 % |
|
2,2923 |
مثال 2:أكتب الصيغة الكيميائية لبلورات كلوريد الحديد III من المعلومات الأتية :
( Fe = 56 , Cl = 35.5 )
كتلة زجاجة الوزن فارغة = 9,375 جم .
كتلة الزجاجة وبها كلوريد الحديد المتهدرت = 10,7275 جم .
كتلة الزجاجة بعد التسخين = 10.1875 جم
الحل:
كتلة المادة المتهدرت = 10.7275 – 9.375 = 1.3525 جم .
الكتلة الجافة = 10.1875 – 9.375 = 0.8125 جم .
كتلة ماء التبلر = 1.3525 – 0.8125 = 0.54 جم
|
عدد مولات جزيئات الماء فى الصيغة = |
0.54 × 162.5 |
= 6 مول جزئ . |
|
0.8125 × 18 |
الصيغة الجزيئية هى FeCl3.6H2O
طريقة الترسيب
تعتمد طريقة الترسيب على ترسيب العنصر أو المركب المراد تقديره على هيئة مركب نقى غير قابل للذوبان فى الماء و ذو تركيب كيميائى معروف و ثابت
ورق الترشيح عديم الرماد
نوع من ورق الترشيح يحترق إحتراقاً كاملاً و لا يترك أى رماد و ذلك حتى لا يؤثر على كتلة الراسب
إشرح خطوات تعين كتلة مادة بطريقة الترسيب ؟
1-يفصل المركب على ورق ترشيح عديم الرماد
2-تنقل ورقة الترشيح و عليها الراسب فى بوتقة إحتراق و تحرق تماماًحتى تتطاير مكونات ورقة الترشيح و يبقى الراسب
3-من كتلة الراسب نحدد كتلة العنصر أو المركب
مثال: أضيف محلول كبريتات الصوديوم الى محلول كلوريد الباريوم حتى تمام ترسيب كبريتات الباريوم و تم فصل الراسب بالترشيح و التجفيف فوجد أن كتلته = 2 جم ، إحسب كتلة كلوريد الباريوم فى المحلول . O = 16 , S = 32 , Na = 23 , Cl = 35.5 , Ba = 137)
الحل:
| BaCl2 + Na2SO4 → BaSO4 + 2NaCl | ||
| 1 مول BaSO4 | → | 1مول من BaCl2 |
| 2 جم | → | كم كتلة كلوريد الباريوم |
| 1 × 233 جم | → | 1 × 208 |
|
كتلة كلوريد الباريوم = |
2 × 208 |
= 1.785 جم . |
|
233 |
علل: استخدام ورق الترشيح عديم الرماد عن اجراء التحليل الكيميائي بطريقة الترسيب ؟
لأنه يحترق تماما دون أن يترك رمادا
مثال:
أذيب 2 جم من كلوريد الصوديوم غير النقى فى الماء و أضيف اليه وفرة من نترات الفضة فترسب 4.628 كلوريد الفضة .
إحسب: 1- كتلة كلوريد الصوديوم . 2- نسبة الكلور فى كلوريد الفضة .
3 – نسبة الكلور فى العينة . 4- نسبة الكلور فى كلوريد الصوديوم .
( Ag = 108 , Na = 23 , Cl = 35.5)
الحل:
1-حساب كتلة كلوريد الصوديوم
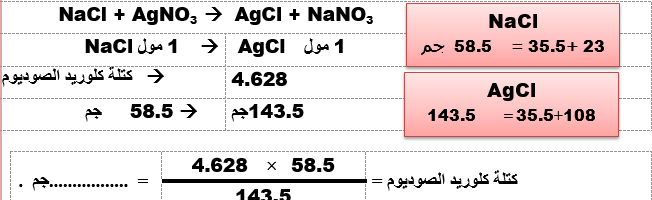
2-حساب نسبة الكلور في كلوريد الفضة:


3-حساب نسبة الكلور في كلوريد الصوديوم

تدريبات
1-أضيف محلول كبريتات الصوديوم إلي محلول كلوريد الباريوم فتم فصل 2 جم من كبريتات الباريوم . احسب كتلة كلوريد الباريوم المستخدمة .
[ Ba = 137 , Cl = 35.5 , O = 16 , S = 32 ]
2-رُسبت أيونات الكلوريد في محلول البوتاسيوم علي صورة كلوريد فضة كتلته 0.1562 جم ما كتلة أيون الكلوريد في هذا المحلول . [ Ag = 108 , Cl = 35.5
3-أذيب 2 جم من كلوريد الصوديوم ” غير نقي ” في الماء وأضيف إليه وفرة من محلول نترات الفضة فترسب 4.628 جم من كلوريد الفضة . احسب نسبة الكلور في العينة .
4-أضيف 10 مل من حمض كبريتيك 0.1 مولر إلي 0.2 جم من عينة غير نقية من كربونات الكالسيوم حتي تمام التفاعل . احسب نسبة كربونات الكالسيوم في العينة علماً بأن معادلة التفاعل CaCO3 + H2SO4 → CaSO4 + H2O + CO2
[ Ca = 40 , C = 12 , O = 16 , S = 32 ]
5-ينتج 0.411 جم من أكسيد الحديد III عند أكسدة نصف جم من خام المجنتيت احسب النسبة المئوية للأكسيد الأسود في الخام . [ Fe = 55.8 , O = 16 ]
6-أضيف محلول نترات الفضة إلي 25 مل من محلول حمض الهيدروكلوريك مجهول التركيز احسب مولارية حمض الهيدروكلوريك علماً بأن جميع الكلوريد قد ترسب .
[ Ag = 108 , Cl = 35.5 , H = 1 ]
7-من التفاعل BaCl22H2O + H2SO4 → BaSO4 + 2HCl + 2H2O
احسب :
أ- كتلة بللورات الباريوم التي تعطي راسب كتلته جم من كبريتات الباريوم .
ب- حجم حمض الكبريتيك – تركيزه 1 مولر – الذي يتفاعل مع 0.25 جم من كلوريد الباريوم المتهدرت . [ Ba = 137 , Cl = 35.5 , O = 16 , S = 32 ]
7-عند تفاعل محلول يحتوي علي أيونات XO42- مع محلول يحتوي علي أيونات Ag+ يتكون راسب :
أ- اكتب المعادلة الأيونية المعبرة عن هذا التفاعل .
ب- عند إضافة 56.7 سم3 من محلول أيونات الفضة تركيزه 0.2 × 10-3 مول/سم3 إلي محلول أيوناته XO42- تكون راسب كتلته 1.88244 جم احسب :
1- عدد مولات أيونات Ag+ المتفاعلة . 2- عدد مولات جزيئات الراسب المتكون .
3- الكتلة الجزيئية الجرامية للراسب 4- الكتلة الذرية الجرامية للعنصر X .
[ Ag = 108 , O = 16 ]
8-بحتوي خام الهيماتيت علي 45% من أكسيد الحديد III ( Fe2O3 ) كم كجم من الخام يلزم لإنتاج طن واحد ( 1000 كجم ) من الحديد . [ Fe = 56 , O = 16 ]
9-يحتوي أحد خامات النحاس علي 13.22% من CuCO3 احسب كتلة الخام اللازمة لإنتاج 300 كجم من النحاس . [ Cu = 63.5 , C = 12 , O = 16 ]
10- من المعادلة :
2C6H12 + 5O2 → 2H2C6H8O4 + 2H2O
احسب :
أ- الكتلة المتوقعة لحمض الأديبكH2C6H8O4 التي يمكن الحصول عليها من 25 جم من الهكسان الحلقي C6H12 .
- احسب النسبة المئوية لحمض الأديبك إذا علمت أن الكتلة الفعلية الناتجة من حمض الأديبك 23.5جم
[ C = 23 , O = 16 , H = 1 ]
10-من التفاعل :
2NaCl+H2SO4 → NaSO4 + 2HCl
احسب كتلة كبريتات الصوديوم درجة نقاءه 83.4% التي يمكن الحصول عليها من 250 كجم من ملح الطعام درجة نقاءه 94.5 % .
