التحليل الكمي الكيميائي
ما المقصود بالتحليل الكمي في الكيمياء؟
التحليل الكيميائي الكمي هو تحليل يستخدم في التعرفلاعلى نسبة كل مكون من المكونات الأساسية للمادة
طرق التحليل الكمي:
أ)التحليل الكمي الحجمي
ب) التحليل الكمي الوزني أو الكتلي
أ)التحليل الكمي الحجمي (طريقة المعايرة):
يتم التحليل الكمي الحجمي بأخذ حجما معلوما من المادة المراد تحديد تركيزها ثم نضيف إليه محلول من مادة معلومة التركيز مسبقا(محلول قياسي) حتى يتم التفاعل الكامل بين المادتين
ما هو المحلول القياسي؟
المحلول القياسي هو محلول معلوم التركيز مسبق
ما المقصود بالمعايرة؟
المعايرة هي عملية الغرض منها معرفة تركيز (حمض أو قاعدة) معلومة الحجم بواسطة استخدام (حمض أو قاعدة) معلومة التركيز والحجم
أو هي عملية الغرض منها معرفة تركيز محلول بواسطة استخدام محلول آخر معلوم التركيز (المحلول القياسي)
كيف يتم تحديد المحلول القياسي المناسب؟
بمعرفة التفاعل المناسب الذي سيتم بين محلولي المادتين المعلوم التركيز والمجهول التركيز
هذه التفاعلات قد تكون :
1-تفاعلات التعادل :وهي تفاعلات تستخدم في تقدير الحمض أو القاعدة
2-تفاعلات الأكسدة والاختزال :وهي تفاعلات تستخدم في تقدير المواد المؤكسة أو المختزلة
3-تفاعلات الترسيب:هي تفاعلات تستخدم في تقدير المواد التي تعطي نواتج شحيحة الذوبان في الماء
ومما سب يتضح أنه :
1-إذا كانت المادة المراد تقديرها حمض نستخدم في المعايرة محلول قياسي قلوي أو قاعدي
2-إذا كانت المادة المراد تقديرها قاعدة نستخدم في المعايرة محلول قياسي حمض
في عملية المعايرة يستخدم مواد تسمي كواشف أو أدلة علل؟
-لمعرفة نقطة التعادل وهي نقطة انتهاء التفاعل
ما المقصود بالأدلة أو الكواشف المستخدمة في المعايرة؟
-الأدلة أو الكواشف هي مواد كيميائية يتغير لونها بتغير الوسط التي توضع فيه
ما المقصود بنقطة التعادل؟
هي النقطة التي عندها تمام التفاعل أو هي النقطة التي عندها ينتهي التفاعل
علل: استخدام الأدلة الكيميائية في تفاعلات المعايرة بين الأحماض والقلويات؟
- لمعرفة نقطة تمام التفاعل
علل: يتغير لون الدليل تبعا لنوع المحلول ؟
- لأن لون الدليل الغير متأين يختلف عند تأينه في المحاليل المائية
بعض الأدلة المستخدمة في تفاعلات التعادل :
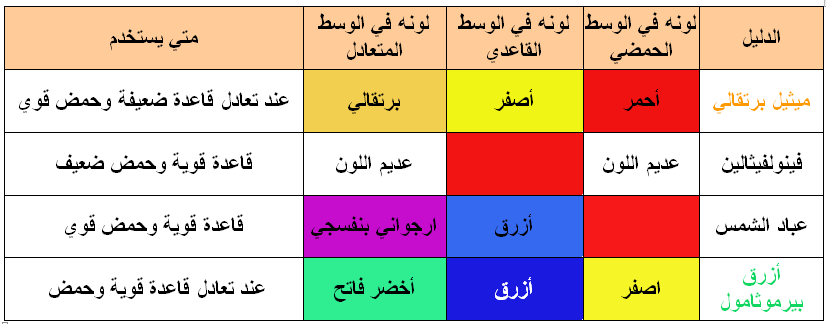
علل:لا يصلح حمض الهيدروكلوريك في التمييز بين المثيل البرتقالي وصبغة دوار الشمس؟
-لأن كل منهما يكون له نفس اللون (أحمر) في الوسط الحمضي
علل:عدم استخدام محلول قاعدي في التمييز بين عباد الشمس وأزرق البروموثيمول؟
- لأن كل منهما لونه أزرق في الوسط القاعدي
تجربة المعايرة
إشرح عملياً كيف يمكنك تعيين تركيز محلول هيدروكسيد الصوديوم معلوم الحجم بمعلومية حمض
1-ننقل 25 مل من هيدروكسيد الصوديوم مجهول التركيز الى دورق مخروطى بإستخدام ماصة
2- يضاف إلي هيدروكسيد الصوديوم قطرتين من محلول دليل مناسب مثل عباد الشمس أو أزرق بروموثيمول
3-نملأ السحاحة بالمحلول القياسى حمض الهيدروكلوريك معلوم التركيز ( 0,1 مولر )
4-يضاف محلول الحمض الى محلول القلوى بالتدريج حتى يتغير لون الدليل مشيراً الى نهاية التفاعل ( نقطة التعادل )
المعادلة :
NaOH + HCl → NaCl + H2O
5-نطبق القانون الأتى : ونفترض ان حجم الحمض المضاف من السحاحة 21 mL .. ويمكن حساب تركيز القاعدة كالاتي
القانون المستخدم فى المعايرة

أمثلة:
أجريت معايرة 20ml من محلول هيدروكسيد الكالسيوم بإستخدام حمض الهيدروكلوريك ( 0,5 mol/L) و عند تمام التفاعل استهلك 25mL من الحمض . إحسب تركيز هيدروكسيد الكالسيوم .
الحل:
Ca(OH)2 + 2HCl >>> CaCl2 +2H2O
مسألة معايرة

مثال2:
إحسب حجم حمض الهيدروكلوريك ( 0.1 مولارى ) اللازم لمعايرة 20 ملليلتر من محلول كربونات الصوديوم ( 0.5 مولارى ) حتى تمام التفاعل .
الحل :
Na2CO3 + 2HCl >>> 2NaCl +2H2O +CO2
| الحمض | القاعدة | |
| 2 | 1 | عدد المولات في المعادلة |
| س | 20×10-3 | الحجم |
| 0.1 | 0.5 | التركيز |
نعوض في القانون :

حجم الحمض =2x 20 x 10–3 x 0.5 / 0.1 x 1
حجم الحمض=0.2
تدريبات
1-مخلوط من مادة صلبة يحتوى على هيدروكسيد الصوديوم و كلوريد الصوديوم , لزم لمعايرة
0,1 جم منه حتى تمام التفاعل 10 ملليمتر من 0,1 مولارى حمض الهيدروكلوريك .
إحسب نسبة هيدروكسيد الصوديوم فى المخلوط
2-احسب تركيز محلول هيدروكسيد الكالسيوم الذي يلزم لمعايرة 20 مل منه 25 مل من حمض الهيدروكلوريك تركيزه 0.5 مولر
3-مخلوط يحتوي علي هيدروكسيد صوديوم وكلوريد صوديوم لزم لمعايرة 0.1 جم منه 10 ملليلتر من حمض الهيدروكلوريك 0.1 مولر ، احسب نسبة هيدروكسيد الصوديوم في المخلوط
4-أضيف 75 مل من حمض هيدروكلوريك تركيزه 0.1 مولر الي 125 مل من محلول هيدروكسيد الباريوم Ba(OH)2 فظل المحلول قاعدياً ولزم لمعادلته إضافة 35 مل أخري من حمض الهيدروكلوريك . احسب تركيز محلول هيدروكسيد الباريوم
5-عينة غير نقية من محلول هيدروكسيد البوتاسيوم كتلتها 0.28 جم تم معايرتها بمحلول حجمه 40 ملليلتر من حمض النيتريك 0.1 مولر لإتمام التعادل . احسب النسبة المئوية لهيدروكسيد البوتاسيوم في العينة . ( K= 39 , O = 16 , H = 1 )
6-عينة من حمض الهيدروكلوريك كتلتها 12.5 جم اذيبت في الماء فّإذا تعادلت مع 65 مل من محلول هيدروكسيد الصوديوم 2.2 مولر . احسب النسبة المئوية لدرجة تركيز الحمض في العينة.
7-أضيف 100 مل من حمض الهيدروكلوريك 0.01 جم / مل إلي 300 مل من حمض الهيدروكلوريك ( 20 جم / مل ) . احسب مولارية المحلول الجديد وكذلك تركيزه بالجرام لكل مل .
8-عينة غير نقية من محلول هيدروكسيد البوتاسيوم كتلتها 0.28 جم تم معايرتها بمحلول حجمه 40 مل من حمض النيتريك 0.1 مولر لإتمام التعادل .. احسب النسبة المئوية لهيدروكسيد البوتاسيوم في العينة .
9-احسب عدد مولات HCl المتكونة وكذلك عدد مولات H2 المتبقية بدون تفاعل عند إضافة 2mol من غاز H2 إلي 5mol من غاز Cl2
10-كم ملليلتر من محلول 25M من هيدروكسيد الصوديوم تلزم لمعادلة 100mL من محلول 0.4M من حمض الكبريتيك ؟
وكم مول من حمض الكبريتيك مذاب في هذا المحلول ؟
وكم مول من هيدروكسيد الصوديوم يلزم للتفاعل مع هذا الحمض ؟
وما كتلة كبريتات الصوديوم المتكونة في المحلول الناتج ؟
