مفهوم الأكسدة والاختزال وأنواع الخلايا الكهربية
ما المقصود بعلم الكيمياء الكهربية؟
علم الكيمياء الكهربية :
هو علم يهتم بدراسة التحول المتبادل بين الطاقة الكيميائية والطاقة الكهربية من خلال تفاعلات الأكسدة والاختزال
تفاعلات الأكسدة والاختزال : هى التفاعلات التى تنتقل فيها الإلكترونات من احد المواد المتفاعلة إلى المادة الأخرى الداخلة معها فى تفاعل كيميائى .
الأكسدة :هي عملية فقد إلكترونات وتحدث عن الأنود
الاختزال: هي عملية اكتساب الكترونات وتحدث عند الكاثود
تجربة توضح مفهوم الأكسدة والإحتزال:

1- نضع لوح خارصين في محلول كبريتات النحاس الزرقاء
2-يترسب فلز النحاس على لوح الخارصين
3-يذوب فلز الخارصين في المحلول ويتكون أيون الخارصي Zn+2
4- يقل لون محلول كبريتات النحاس الزرقاء تديريجيا حتى يختفي ويزداد زوبان فلز الخارصين
الاستنتاج:
نستنتج حدوث تفاعل أكسدة وإختزال تلقائي يمكن التعبير عنه بالمعادلة:
هذا التفاعل يتكون من نصفين تفاعل :
1- تفاعل أكسدة :
Zn(s)o ⇒ Zn(aq)+2 + 2e–
– فيه تفقد كل ذرة خارصين Zn إلكترونين متحولة إلى أيون خارصين موجب Zn+2 الذى يترك سطح صفيحة الخارصين ويذوب وينتشر فى المحلول .
2- تفاعل اختزال :
Cu(aq)+2 + 2e– ⇒ Cu(s)o
– فيه يكتسب كل أيون نحاس Cu+2 فى المحلول إلكترونين ( القادمين من نصف خلية الخارصين ) ويتحول إلى فلز النحاس Cu الذى يترسب على سطح صفيحة الخارصين .
ملاحظات هامة:
– تمكن العلماء من فصل مكونات نصفى الخلية مع اتصالهما عن طريق قنطرة ملحية والسماح للإلكترونات أن تمر فى سلك بين نصفى الخلية وبذلك يمكن الحصول على تيار كهربى ناتج من تفاعل الأكسدة والاختزال التلقائى الذى يحدث فى الخلية الجلفانية
– هناك نوع آخر من الخلايا الكهربية تستخدم فيها طاقة كهربية من مصدر خارجى ( مثل بطارية جافة ) لإحداث تفاعلات أكسدة واختزال ( غير تلالمتروليتية)قائية ) تسمى الخلايا الإلكتروليتية ( خلايا التحليل الكهربى )
أنواع الخلايا الكهربية
تنقسم الخلايا الكهربية إلى نوعين:
1- خلايا كهربائية جلفانية
2- خلايا كهربية تحليلية (الكتروليتية)
الخلية الجلفانية
الخلايا الجلفانية : خلايا يمكن الحصول منها على تيار كهربى نتيجة حدوث تفاعل أكسدة واختزال بشكل تلقائى
مثال لخلية جلفانية ( خلية دانيال )

التركيب :
1- إنائين من الزجاج .
2- يوضـع فى أحد الإنائين فلز النحـاس ( قطب نحاس ) مغمور فى محلول أيونات النحاس ( كبريتات النحاس II ) ويسمى لوح النحاس ( مهبط أو كاثود ) وهو القطب الموجب فى الخلية .
3- يوضع فى الإناء الآخر فلز الخارصين ( قطب الخارصين ) مغمور فى محلول أيونات الخارصين ( كبريتات خارصين ) ويسمى لوح الخارصين ( مصعد أو آنود ) وهو القطب السالب فى الخلية .
4- كل إناء بما فيه يمثل نصف خلية .
5- المحلول الموجود فى كل نصف خلية يسمى إلكتروليت .
تفسير عمل الخلية :
عند توصيل الأقطاب فى نصفى الخلية بسلك معدنى موصل يمر تيار كهربى ونجد أن :
1- عند الآنود : تحدث أكسدة للخارصين
–Zn(s)o ⇒ Zn(aq)+2 + 2e
2- عند الكاثود : يحدث اختزال لأيونات النحاس
Cu(aq)+2 + 2e– ⇒ Cu(s)o
3- يكون التفاعل الكلى الحادث فى الخلية هو مجموع تفاعلى نصف الخلية

4- نتيجة لانتقال الإلكترونات فى السلك من الخارصين إلى النحاس يمر تيار كهربى .
5- ينشأ فرق جهد كهربى بين نصفى الخلية .
6- يتوقف مرور التيار الكهربى بين نصفى الخلية عندما يذوب كل من فلز الخارصين فى نصف خلية الخارصين أو تنضب أيونات النحاس بسبب ترسبها على هيئة ذرات نحاس CuOفى نصف خلية النحاس .
ملاحظات هامة
القنطرة الملحية :عبارة عن أنبوبة زجاجية على شكل حرف U تملأ بمحلول إلكتروليتى مثل ( كبريتات الصوديوم Na2SO4 ) لا تتفاعل أيوناته مع أيونات محاليل نصفى الخلية ولا مع مواد أقطاب الخلية الجلفانية
وظيفة القنطرة الملحية :
تقوم بالتوصيل بين محلولى نصفى الخلية
تمنع الاتصال المباشر بين المحلولين
تقوم بمعادلة الشحنات الموجبة والسالبة التى تتكون فى محلولى نصفى الخلية نتيجة تفاعل الأكسدة والاختزال فى نصف خلية الخارصين ونصف خلية النحاس على التوالى
غياب القنطرة الملحية يسبب :
– يؤدى إلى توقف تفاعل الأكسدة والاختزال وبالتالى يتوقف مرور التيار الكهربى فى السلك الخارجى الموصل بين نصفى الخلية
– يمكن تمثيل الخلية الجلفانية بالرمز الاصطلاحى الآتى :

حيث : الخط الفردى ( | ) يمثل الحد الفاصل بين قطب العنصر والمحلول الإلكتروليتى لأيوناته
الخطان المزدوجان ( ||) يمثلان الحد الفاصل بين المحلولين فى نصفى الخلية ( أو القنطرة الملحية )
– الخلايا الجلفانية عكس الخلايا التحليلية التى يوجد بها مصدر خارجى للتيار الكهربى حيث أن :
أ- الآنود يعتبر القطب السالب لأن عملية الأكسدة تحدث عند الآنود مما يؤدى إلى تكوين الإلكترونات عنده وهى مصدر الشحنة الكهربية التى تسرى خلال السلك إلى الكاثود .
ب- الكاثود يعتبر القطب الموجب لأنه تحدث عنده عملية اختزال حيث يستقبل الإلكترونات .
– عند كتابة الرمز الاصطلاحى للخلية الجلفانية يكتب نصف خلية الآنود جهة اليسار ونصف خلية الكاثود جهة اليمين
مثال : أكتب الرمز الاصطلاحى للخلية الجلفانية التى يحدث بها التفاعل الآتى :
Ni+2 + Fe ⇒ Ni + Fe+2
الحل :
التفاعل عند الآنود و هو الحديد :
Fe ⇒ Fe +2 + 2e
التفاعل عند الكاثود و هو النيكل :
Ni +2 + 2e ⇒ Ni
الرمز الاصطلاحى :
Fe / Fe+2 // Ni+2 / Ni
قياس الجهد الكهربى لأقطاب الخلية الجلفانية
قياس الجهد الكهربى للأقطاب :كيف نقيس الجهد الكهربي للخلية؟
– لقياس الجهد الكهربى للأقطاب المختلفة لابد من إعداد خلية جلفانية من القطب المراد قياس جهده وقطب آخر قياسى معلوم الجهد ثم قياس القوة الدافعة الكهربية للخلية ( جهد الخلية ) ومنها يمكن حساب جهد القطب الغير معلوم .
– لذلك استخدم قطب الهيدروجين ( جهده معلوم = صفر ) كقطب قياسى
قطب الهيدروجين :
التركيب :

– صفيحة من البلاتين مساحتها 1 cm2 مغطاة بطبقة اسفنجية من البلاتين الأسود يمرر عليها تيار من غاز الهيدروجين تحت ضغط ثابت قدره واحد ضغط جوى ومغمورة فى محلول واحد مولر ( 1mol ̸ L ) من أى حمض قوى
– يسمى قطب الهيدروجين تحت هذه الظروف ( قطب الهيدروجين القياسى SHE ) وجهده = صفر
أهمية قطب الهيدروجين : قياس جهود الأقطاب الأخرى المجهولة بمعلومية جهده الذى يساوى صفراً
لاحظ: يتغير جهد قطب الهيدروجين عن الصفر بتغير تركيز أيون الهيدروجين فى المحلول أو بتغير الضغط الجزئى للغاز أو كلاهما .
– يرمز لنصف خلية الهيدروجين القياسية بالرمز الاصطلاحى
Pt – H2 ( 1 atm. ) / 2H+ ( 1 mol /L )
سلسلة الجهود الكهربية للعناصر
– تمكن العلماء من قياس الجهود القطبية القياسية Eo لأنصاف الخلايا لجميع العناصر الفلزية واللافلزية مقاسة بالنسبة لجهد الهيدروجين القياسى .
– أمكن ترتيب هذه الجهود القياسية :
أ- تنازلياً بالنسبة لجهود الاختزال السالبة بحيث تكون أكبر القيم السالبة فى أعلى السلسلة .
ب- تصاعدياً بالنسبة لجهود الاختزال الموجبة بحيث تكون أكبر القيم الموجبة فى أعلى السلسلة .
سلسلة الجهود الكهربية للعناصر :
ترتيب العناصر ترتيباً تنازلياً حسب قيمة جهود التأكسد القياسية لها بالنسبة لجهد قطب الهيدروجين القياسى
بعض الحقائق عن السلسلة:
العناصر ( الفلزات ) ذات الجهود الأكثر سالبية والتى تقع عند قمة السلسلة تعتبر عوامل مختزلة قوية :
لأنها تتأكسد بسهولة أى أنها تفقد إلكتروناتها بسهولة عندما تدخل فى تفاعل مع أيونات أى عنصر يحتل مكانة أدنى فى السلسلة .
العناصر ذات الجهود الأكثر إيجابية والتى تقع عند النهاية السفلى للسلسلة تعتبر عوامل مؤكسدة قوية :
( مثل جزيئات الفلور ( F2 ) لأنها ذات قدرة أكبر على اكتساب الإلكترونات عندما تدخل فى تفاعل مع أى عنصر يحتل مكانة أعلى فى السلسلة
العناصر المتقدمة فى السلسلة تحل محل العناصر التى تليها فى محاليل أملاحها : وكلما زاد البعد فى الترتيب بين عنصرين كلما زادت قدرة العنصر المتقدم ( ذو الجهد الأكثر سالبية أو الأقل إيجابية ) على طرد العنصر المتأخر ( ذو الجهد الأقل سالبية أو الأكثر إيجابية ) من مركباته .
جميع العناصر التى تقع فوق الهيدروجين فى سلسلة الجهود الكهربية : تحل محل أيونات الهيدروجين فى المحاليل الحمضية ( أى يتصاعد الهيدروجين )
مثال : تفاعل الحديد مع حمض الهيدروكلوريك
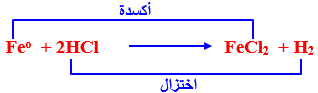
– أى أنه كلما زادت القيمة السالبة للجهد كلما زاد الميل نحو الإحلال محل أيونات الهيدروجين .
– أما العناصر ذات الجهود الموجبة أى التى تقع تحت الهيدروجين فى سلسلة الجهود الكهربية لا تحل محل أيونات الهيدروجين فى محاليله .
– الجهد القياسى لنصف خلية أى عنصر يأخذ إشارة سالبة أو موجبة .
مثلاً : إذا كان التفاعل فى نصف خلية الخارصين عبارة عن عملية اختزال فإن الجهد هنا يعرف بجهد الاختزال القياسى Eo
Zn+2 + 2e– ⇒ Zno
– جهد الاختزال Eo لنصف خلية الخارصين بالنسبة لجهد الهيدروجين القياسى يساوى ـ 0.76 فولت ولكن جهد التأكسد لهذا العنصر يكون ذو إشارة مخالفة حيث يمثل هنا عملية أكسدة .
Zno ⇒ Zn+2 + 2e– Eo + = 0.76
– لذلك يمكن أيضاً ترتيب سلسلة الجهود الكهربية للعناصر حسب جهود الأكسدة القياسية :
أ- تنازلياً بالنسبة للجهود الموجبة .
ب- تصاعدياً بالنسبة للجهود السالبة .
– يمكن حساب القوة الدافعة الكهربية لأى خلية جلفانية وذلك باستخدام جهد الاختزال أو جهد الأكسدة لنصفى الخلية أو كلاهما معاً بحيث يكون لجهد الخلية الجلفانية قيمة موجبة دائماً .
مثال :
1- جهد الأكسدة القياسى لنصف خلية الخارصين = + 0.76 فولت
2- جهد الاختزال القياسى لنصف خلية الخارصين = ــ 0.76 فولت
3- جهد الأكسدة القياسى لنصف خلية النحاس = ــ 0.34 فولت
4- جهد الاختزال القياسى لنصف خلية النحاس = + 0.34 فولت
– عند إعداد خلية جلفانية من قطبى الخارصين والنحاس تحدث عملية تأكسد فى قطب الخارصين وبالتالى تحدث عملية اختزال فى قطب النحاس .
– ينشأ عن ذلك فرق جهد للخلية يسمى القوة الدافعة الكهربية ( ق . د . ك )
كيف نحسب القوة الدافعة الكهربية ؟
القوة الدافعة الكهربية تحسب كالآتى :
ق . د . ك = جهد أكسدة الآنود +جهد اختزال الكاثود
ق . د . ك =جهد أكسدة الآنود ـــ جهد أكسدة الكاثود
ق . د . ك =جهد اختزال الكاثود ـــ جهد اختزال الآنود
∴ ق . د . ك = جهد أكسدة الآنود + جهد اختزال الكاثود
ق . د . ك = جهد أكسدة الخارصين ـــ جهد اختزال النحاس
= 0.76 + 0.34 = 1.1 فولت
ق . د . ك = جهد أكسدة الآنود – جهد اختزال الكاثود
ق . د . ك = جهد أكسدة الخارصين – جهد أكسدة النحاس
= 0.76 ـــ ( 0.34 – ) = 1.1 فولت
ق . د . ك = جهد اختزال الكاثود – جهد اختزال الآنود
ق . د . ك = جهد اختزال النحاس – جهد اختزال الخارصين
= 0.34 ـــ ( 0.76 – ) = 1.1 فولت
ملاحظات هامة:
فرق الجهد فى الخلية الجلفانية التى يحدث فيها التفاعل التلقائى لابد أن تكون قيمته موجبة ، لكن جهود أنصاف الخلايا يمكن أن تكون سالبة أو موجبة مقاسة بالنسبة لقطب الهيدروجين القياسى
إذا كان المجموع موجباً يدل ذلك على إمكانية حدوث تفاعل تلقائى وإنتاج طاقة كهربية والعكس صحيح .
مثال : جهد التأكسد لقطب النحاس = ــ 0.34 فولت وجهد الاختزال لقطب الخارصين = ــ 0.76 فولت
∴ مجموع جهدى التأكسد والاختزال = 0.34 + ( ــ 0.76) = ــ 1.1 فولت
لا يمكن الحصول على طاقة كهربية من خلية يكون فيها التأكسد عند قطب النحاس والاختزال عند قطب الخارصين والعكس صحيح
جهد الاختزال القياسى لأى عنصر ( ºE ) يساوى جهد الأكسدة القياسى له ( ºE ) و لكن بعكس الإشارة
مثال : إذا كان جهد اختزال الخارصين القياسى ( ºE ) = – 0.76 فولت
فإن جهد أكسدة الخارصين القياسى ( ºE ) = 0.76 فولت
الآنود هو القطب الأعلى فى جهد الأكسدة والأقل فى جهد الاختزال ، الكاثود هو القطب الأعلى فى جهد الاختزال والأقل فى جهد الأكسدة
اتجاه التيار الكهربى من الآنود الى الكاثود فى السلك و من الكاثود الى الآنود فى المحلول
جهد أكسدة قطب الهيدروجين = جهد اختزاله = صفراً
تدريب
علل:
يعتبر الآنود هو القطب السالب فى الخلية الجلفانية .
لأنه تحدث عنده عملية الأكسدة وتتراكم الإلكترونات الناتجة على سطحه
يستخدم فى الخلية الجلفانية قنطرة ملحية
لأنها
1- تقوم بالتوصيل بين محلولى نصفى الخلية
2- تمنع الاتصال المباشر بين المحلولين
3- تقوم بمعادلة الشحنات الموجبة والسالبة التى تتكون فى محلولى نصفى الخلية نتيجة تفاعل الأكسدة والاختزال فى نصف خلية الخارصين ونصف خلية النحاس على التوالى
4-يتوقف تولد التيار الكهربى الصادر من الخلية الجلفانية عند رفع القنطرة الملحية
لتراكم الأيونات فى نصفى الخلية مما يؤدى لتوقف تفاعل الأكسدة والاختزال وبالتالى توقف مرور التيار الكهربى فى السلك الخارجى الموصل بين نصفى الخلية وتوقف انتقال الأيونات بين محلول نصفى الخلية
5-لا يمكن قياس جهداً الفلز منفرداً .
لأن الفلز فى محلول أيوناته يمثل نصف خلية ولابد من توصيله بقطب آخر معلوم الجهد وهو الهيدروجين حيث أن جهده = صفر الجهد القياسى للهيدروجين قد لا يساوى الصفر أحياناً بسبب تغير تركيز أيون الهيدروجين فى المحلول أو بسبب تغير الضغط الجزئى للغاز عن 1 ضغط جوى
6- عناصر مقدمة المتسلسلة عوامل مختزلة قوية بينما عناصر المؤخرة عوامل مؤكسدة قوية
-لأن عناصر المقدمة جهد تأكسدها عالى فتميل إلى فقد إلكترونات بينما عناصر المؤخرة جهد اختزالها عالى فتميل إلى اكتساب إلكترونات
7-يحل الخارصين محل النحاس فى محاليل أملاحه لا يحدث العكس
-لأن جهد أكسدة الخارصين أعلى من جهد أكسدة النحاس ولذلك فإن الخارصين يسبق النحاس فى السلسلة الكهروكيميائية
8- لا يحل النحاس محل هيدروجين الماء أو الأحماض المخففة ، بينما يحل الصوديوم محل هيدروجين الماء أو الأحماض المخففة
لأن جهد أكسدة النحاس أقل من جهد أكسدة الهيدروجين بينما جهد أكسدة الصوديوم أكبر من جهد أكسدة الهيدروجين
9- لا تحفظ كبريتات النحاس فى أوانى من الحديد
لأن جهد أكسدة الحديد أعلى من جهد أكسدة النحاس فيحل محله فى محاليل أملاحه
أنواع الخلايا الجلفانية
– تنقسم الخلايا الجلفانية حسب طبيعة عملها لإنتاج الطاقة الكهربية إلى نوعين :
1- خلايا أولية
ب- خلايا ثانوية
أولاً : الخلايا الأوليــــة:
هى أنظمة تختزن الطاقة فى صورة كيميائية يمكن تحويلها إلى طاقة كهربية من خلال تفاعل أكسدة واختزال تلقائى غير انعكاسى
خصائصها :
1- لا يسهل ( من المستحيل ) إعادة شحنها لأنها غير انعكاسية .
2- تكون فى صورة جافة ليست سائلة ليسهل استخدامها فى الأجهزة المتنقلة ( لذلك تسمى البطاريات الجافة )
3- تحقق جهداً ثابتاً لمدة طويلة أثناء تشغيلها ويمكن تصنيعها فى أحجام صغيرة .
خليــــــــة الزئبق:
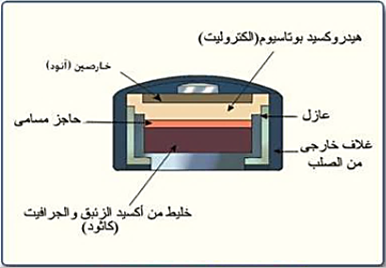
– تصنع فى شكل اسطوانى أو على هيئة قرص وتتكون من :
1- قطب سالب من الخارصين .
2- قطب موجب من أكسيد الزئبق .
3- إلكتروليت هيدروكسيد بوتاسيوم .
التفاعل الكلى الحادث فى هذه الخلية هو :

