الكشف عن الشقوق القاعدية – الكاتيونات
لماذا يعد الكشف عن الشقوق القاعدية أكثر تعقيدا من الكشف عن الشقوق الحامضية؟
بسبب كثرة الشقوق القاعدية و التداخل فيما بينها بالإضافة الى امكانية وجود الشق الواحد فى أكثر من حالة تأكسد.
تقسم الشقوق القاعدية الى ست مجموعات تحليلية بناء على اختلاف ذوبان املاح هذه الفلزات فى الماء ولكن سوف نتناول بعض من هذه المجموعات الستة بالدراسة
أولا:المجموعة التحليلية الأولي
الأساس العلمى:كلوريدات المجموعة التحليلة الاولى هى كلوريدات الفلزات شحيحة الذوبان فى الماء و هى كلوريد الفضة (I) و كلوريد الرصاص (II) و كلوريد الزئبق ( I) و لذلك ترسب على هيئة كلوريدات بإضافة كاشف المجموعة و هو حمض الهيدروكلوريك المخفف .
كاتيونات المجموعة : +Pb2+ , Ag1+ , Hg1
ثانيا: المجموعة التحليلة الثانية
الأساس العلمى :يمكن ترسيب كاتيونات هذه المجموعة على هيئة كبريتيدات فى الوسط الحمضى و يتم ذلك بإذابة الملح فى الماء و إضافة حمض الهيدروكلوريك المخفف ( علل ) ليصبح المحلول حمضى ثم يمرر فيه غاز كبريتيد الهيدروجين وسوف ندرس كيف نكشف عن أحد كاتيونات هذه المجموعة وهو
كيف نستدل على كاتيون : +Cu2
كاتيون النحاس +Cu2
التجربة الأساسية
محلول ملح النحاس + كاشف المجموعة (H2S+HCl)

الراسب الناتج و الكشف عنه
يتكون راسب اسود من كبريتيد النحاس II يذوب فى حمض النيتريك الساخن
المجموعة التحليلة الثالثة
الاساس العلمي:يمكن ترسيب كاتيونات هذه المجموعة على هيئة هيدروكسيدات بإضافة هيدروكسيد الامونيوم و ذلك عندما لا تكون مختلطة بكاتيونات أخرى .
من كاتيونات هذه المجموعة:
1- كاتيون الحديد (II) 2- كاتيون الحديد (III) 3- كاتيون الالومنيوم
التجربة الاساسية : محلول الملح + كاشف المجموعة ( هيدروكسيد الامونيوم )
كاتيون الألومنيوم +Al3
التجربة الأساسية:هيدروكسيد الامونيوم ( كاشف المجموعة) + محلول الملح

الراسب الناتج و الكشف عنه
يتكون راسب ابيض جيلاتينى من هيدروكسيد الالومنيوم يذوب فى الاحماض المخففة و فى محلول الصودا الكاوية
![]()
تجربة تأكيدية للكاتيون
محلول الملح + محلول هيدروكسيد الصوديوم فيتكون راسب أبيض جيلاتينى من هيدروكسيد الالومنيوم

يذوب فى وفرة من هيدروكسيد الصوديوم مكوناً ميتا الومينات الصوديوم و الماء .

الراسب الناتج و الكشف عنه
;تكون راسب ابيض جيلاتينى من هيدروكسيد الالومنيوم يذوب فى الاحماض المخففة و فى محلول الصودا الكاوية .
![]()
تجربة تأكيدية للكاتيون:
محلول الملح + محلول هيدروكسيد الصوديوم فيتكون راسب أبيض جيلاتينى من هيدروكسيد الالومنيوم
![]()
يذوب فى وفرة من هيدروكسيد الصوديوم مكوناً ميتا الومينات الصوديوم و الماء .

كاتيون الحديد +Fe2
التجربة الأساسية
هيدروكسيد الامونيوم ( كاشف المجموعة) + محلول الملح .

الراسب الناتج و الكشف عنه
يتكون راسب ابيض من هيدروكسيد الحديد II يتحول الى ابيض مخضر عند التعرض للهواء الجوى و يذوب فى الاحماض .
![]()
التجربة التأكيدية للكاتيون
محلول الملح + محلول هيدروكسيد الصوديوم فيتكون راسب أبيض مخضر من هيدروكسيد الحديد II

الراسب الناتج و الكشف عنه
تكون راسب ابيض من هيدروكسيد الحديد II يتحول الى ابيض مخضر عند التعرض للهواء الجوى و يذوب فى الاحماض .
![]()
التجربة التأكيدية للكاتيون :
حلول الملح + محلول هيدروكسيد الصوديوم فيتكون راسب أبيض مخضر من هيدروكسيد الحديد II

كاتيون الحديد +Fe3
التجربة الأساسية
هيدروكسيد الامونيوم ( كاشف المجموعة) + محلول الملح

الراسب الناتج و الكشف عنه
يتكون راسب جيلاتينى لونه بنى محمر من هيدروكسيد الحديد III يذوب فى الاحماض

التجربة التأكيدية للكاتيون
محلول الملح + محلول هيدروكسيد الصوديوم فيتكون راسب بنى محمر من هيدروكسيد الحديد III


المجموعة التحليلة الخامسة
الأساس العلمى
يمكن ترسيب كاتيونات هذه المجموعة على هيئة كربونات بإضافة محلول كربونات الامونيوم و ذلك عندما لا تكون مختلطة بكاتيونات أخرى .
من كاتيونات هذه المجموعة : كاتيون الكالسيوم Ca+2
التجربة الاساسية : محلول الملح + كاشف المجموعة ( محلول كربونات الأمونيوم )
كاتيون الكالسيوم +Ca2
التجربة الأساسية
كربونات الأمونيوم ( كاشف المجموعة) + محلول الملح .
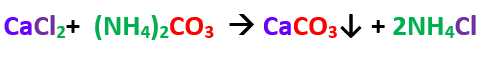
تفاعل كلوريد الكالسيوم مع كربونات الأمونيوم
الراسب الناتج و الكشف عنه
يتكون راسب ابيض من كربونات الكالسيوم يذوب فى حمض الهيدروكلوريك المخفف و يذوب كذلك فى الماء المحتوى على CO2
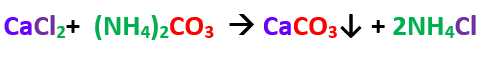

تجربة تأكيدية للكاتيون ( 1 )
محلول الملح + حمض كبريتيك مخفف
فيتكون راسب أبيض من كبريتات الكالسيوم .

تجربة تأكيدية للكاتيون ( 2 ) :
بالكشف الجاف : كاتيونات الكالسيوم المتطايرة تكسب لهب بنزن لون أحمر طوبى
تدريبات
[1]علل لما يأتي تعليلاً علمياً
1.يعتبر الكشف عن الشق القاعدي أكثر تعقيداً من الكشف عن الشق الحامضي .
2.حمض الهيدروكلوريك المخفف هو كاشف المجموعة التحليلية الأولي .
3.كاشف المجموعة التحليلية الثانية هو غاز كبريتيد الهيدروجين ( في وجود حمض هيدروكلوريك مخفف )
4.كاشف المجموعة التحليلة الخامسة هو كربونات الأمونيوم .
5.يتكون راسب أبيض عند إضافة محلول كربونات الأمونيوم إلي محلول كلوريد الكالسيوم.
[2] اذكر اسم الراسب المشار اليه في كل مما يأتي موضحاً متي يتكون :
- راسب أبيض يتحول إلي أبيض مخضر بالتعرض للهواء ويذوب في الأحماض .
- راسب جيلاتيني لونه بني محمر يذوب في الأحماض .
- راسب أبيض يذوب في حمض HCl المخفف ويذوب في الماء المحتوي علي CO2
- راسب اسود يذوب في حمض النيتريك الساخن .
[3]اذكر ماذا يحدث في الحالات الآتية مع التوضيح بالمعادلات :
- إضافة محلول هيدروكسيد الأمونيوم إلي :
- محلول كبريتات الألومنيوم III – محلول كبريتات الحديد II – محلول كلوريد الحديد III
- إضافة محلول هيدروكسيد الصوديوم إلي :
- محلول كبريتات الألومنيوم III – محلول كبريتات الحديد II – محلول كلوريد الحديد III
- إضافة محلول كربونات الأمونيوم إلي محلول كلوريد الكالسيوم .
- إضافة حمض كبريتيك مخفف إلي محلول كلوريد الكالسيوم .
- إمرار غاز كبريتيد الهيدروجين في المحلول الحمضي لكبريتات النحاس .
- اذابة كربونات الكالسيوم في الماء المحتوي علي CO2
[4]كيف يمكنك التمييز بين :
- كبريتات النحاس وكلوريد الكالسيوم .
- كبريتات الألومنيوم III وكبريتات الحديد II
- كبريتات الحديد II وكلوريد الحديد III
