أعداد الكم الأربعة
الأعداد الكمية هي مجموعة من أربعة معلمات تصف الحالة الكمية لإلكترون في ذرة.
توفر هذه الأعداد معلومات هامة حول طاقة الإلكترون وشكل المدار واتجاهه في الفضاء ودورانه.
تعتبر هذه الأعداد الكمية أساسية في فهم البنية الإلكترونية للذرات.
الأعداد الكمية الأربع هي:
العدد الكمي الرئيسي (n):

التعريف: يمثل هذا العدد الكمي المستوى الرئيسي للطاقة أو الغلاف الذي يتواجد فيه الإلكترون.
يصف بعد الإلكترون عن النواة.
كلما زادت قيمة “n” ، زادت مستوى الطاقة وزاد بعد الإلكترون عن النواة. رموزها
: K، L، M، N، O، P، Q
أمثلة:
بالنسبة لـ n = 1، 2، 3، 4، وهكذا ، لدينا المستوى الأول والثاني والثالث والرابع والمستويات العليا ، على التوالي.
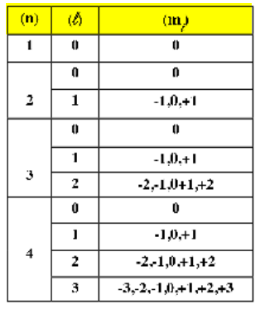
رقم المستوى (n): مع رموزها
العدد الكمي الرئيسي (n) يمثل المستوى الرئيسي للطاقة أو الغلاف الذي يتواجد فيه الإلكترون. يرتبط كل مستوى طاقة برمز محدد.
فيما يلي رموز للمستويات الأولى:
n = 1 : يُعرف المستوى الأول بشكل شائع باسم “الغلاف K” .
n = 2 : يُعرف المستوى الثاني بشكل شائع باسم “الغلاف L” .
n = 3 : يُعرف المستوى الثالث بشكل شائع باسم “الغلاف M” .
n = 4 : يُعرف المستوى الرابع بشكل شائع باسم “الغلاف N” .
n = 5 : يُعرف المستوى الخامس بشكل شائع باسم “الغلاف O” .
n = 6 : يُعرف المستوى السادس بشكل شائع باسم “الغلاف P” .
n = 7 : يُعرف المستوى السابع بشكل شائع باسم “الغلاف Q” .
تُستخدم هذه الرموز لوصف مستويات الطاقة المختلفة للإلكترونات في الذرة ، وهي مستمدة من التطور التاريخي لنظرية الذرات.
يمكن أن يحتوي كل مستوى طاقة على مدارات فرعية واحدة أو أكثر (تُعرف بالعدد الكم الفرعي أو الزاوي)، بأشكال متنوعة.
عدد الإلكترونات في كل عدد كمي رئيسي
- العدد الكلي للإلكترونات التي يمكن استيعابها في كل رقم كمي رئيسي (n) يُعطى بواسطة الصيغة:
عدد الإلكترونات في الغلاف (n) = 2n^2
- توفر هذه الصيغة العدد الأقصى للإلكترونات التي يمكن أن تحتل مستوى الطاقة أو الغلاف المعطى (n) في الذرة.
وفيما يلي أعداد الإلكترونات القصوى في الأعداد الكمية الرئيسية الأولى (n) :
- بالنسبة لـ n = 1: 2 يمتليء 2 الكترون
- بالنسبة لـ n = 2: يمتليء 8 الكترونات
- بالنسبة لـ n = 3 يمتليء 18الكترونا
- بالنسبة لـ n = 4 تمتليء بـ 32 إلكترونًا
مهم أن نلاحظ أن هذه الصيغة تعطي السعة القصوى لكل مستوى طاقة، ولكن ليس كل مستوى طاقة ممتليء بالكامل في الذرات الحقيقية.
توزيع الإلكترونات الفعلي في الذرة يعتمد على العدد الذري للذرة وملء المدارات الفرعية الخاصة داخل كل مستوى طاقة، والتي تحدد بواسطة مبدأ استبعاد بولي وقاعدة هوند.
لماذا لا يتم تطبيق قاعدة (number of electron) = 2n^2 على المستوى الأعلى من المستوى الرابع؟
لأن الذرة تصبح غير مستقرة عندما يكون لديها أكثر من 32 إلكترونًا.
ومع ذلك، يصبح الأمر أقل دقة للمستويات الطاقية الأعلى بسبب نمط معقد للإلكترونات عند ملء الذرات عندما نتحرك بعيدًا عن النواة.
عندما نتجاوز المستوى الرابع، تظهر عوامل إضافية مثل وجود حواجز الإلكترونات الداخلية وتفاعلات الإلكترون مع إلكترون(التنافر بينها)، مما يجعل التوزيع الفعلي للإلكترونات في هذه المستويات الطاقية الأعلى مختلفًا عن الصيغة المبسطة.
طاقة المستويات الرئيسية
- تزيد طاقة مستويات الطاقة (الغلاف) في الذرة عمومًا كلما ابتعدنا عن النواة.
- الإلكترونات في أدنى مستويات الطاقة يكون لديها طاقة أقل، بينما تزيد طاقة الإلكترونات في مستويات الطاقة الأعلى.
- تحدد ميكانيكا الكم الطاقات الدقيقة للإلكترونات في الذرة وتعتمد على العدد الذري للعنصر.
- يمكن تسمية المستويات الطاقية باستخدام العدد الكمي الرئيسي (n)، حيث تتناسب القيم الأعلى لـ n مع مستويات طاقة أعلى.
- تكون مستويات الطاقة للذرات التي تحتوي على عدة إلكترونات أكثر تعقيدًا بسبب تفاعلات الإلكترون- إلكترون وتأثيراتها.
- الإلكترونات في نفس مستوى الطاقة لا تكون بالضرورة لديها نفس الطاقة بسبب هذه التفاعلات.
العدد الكمي الثانوي الفرعي أو الزاوي (l)
يُطلق عليه اسم العدد الكمي الفرعي (l) العدد الكمي الزاوي ، المعروف أيضًا باسم العدد الكمي للزخم الزاوي أو العدد الكمي الأزيموث، يُرمز له بالحرف “l” .
هذا العدد الكمي هو واحد من أربعة أعداد كمية تُستخدم لوصف الحالة الكمية لإلكترون في ذرة، ويوفر معلومات حول شكل المدار الإلكتروني
- يحدد هذا العدد الكمي شكل المدار الإلكتروني
- يُطلق عليه أيضًا اسم العدد الكمي الأزيموث.
أمثلة:
بالنسبة لكل قيمة من “n”، يمكن أن تكون هناك قيم متعددة ل :ـ “l” حسب العلاقة
من :] 0 إلى n-1))[ وكل قيمة تتوافق مع نوع معين من المدار.
على سبيل المثال، عندما n = 2 ، يمكن أن تكون قيم L هي 0 أو 1، مما يتوافق مع المدارات s و p، على التوالي.
وفيما يلي السمات الرئيسية للرقم الكمي الثانوي الفرعي (l):
- التعريف: العدد الكمي الفرعي (l) يحدد شكل المدار الإلكتروني داخل مستوى طاقة معين (العدد الكمي الرئيسيn (
- يُحدد نوع الأغلفة الفرعية أو المدار الفرعي الذي يتواجد فيه الإلكترون.
- القيم: القيم الممكنة للرقم الكمي الفرعي (l) تتراوح بين 0 و (n-1)، حيث “n” هو العدد الكمي الرئيسي للمستوى الطاقي.
- بعبارة أخرى، إذا كان العدد الكمي الرئيسي (n) هو 1، فيكون l هو فقط 0، وإذا كان n هو 2، فيكون قيم l هو: 0 أو 1، وهكذا.
- تسميات الأغلفة الفرعية: كل قيمة من “l” تتوافق مع نوع محدد من الأغلفة الفرعية أو المدار الفرعي.
التسميات هي كالتالي:
- l = 0تتوافق مع مدار s .
- l = 1 تتوافق مع مدار p .
- l = 2 تتوافق مع مدار d .
- l = 3 تتوافق مع مدار f .
عدد الأغلفة الفرعية
- عدد المدارات الفرعية الممكنة في مستوى طاقة يساوي عدد القيم الممكنة لـ “l”.
على سبيل المثال، في المستوى الطاقة الثاني (n = 2)، هناك قيمتين ممكنتين
لـ “l” هما ( 0 و 1) ، مما يعني وجود نوعين من الأغلفة الفرعية ( (s و p))
- . العدد الكمي الفرعي (l) ضروري لفهم تنوع أشكال المدارات وتوجيهاتها داخل مستوى الطاقة.
حيث يلعب دورًا حاسمًا في تحديد بنية سحابة الإلكترون حول النواة ويُعتبر جزءًا أساسيًا من النموذج الكمي الميكانيكي للذرة.
رموز الأغلفة الفرعية وقيم الـ l:
فيما يلي جدول يسرد رموز المدارات الفرعية (المدارات الفرعية) وقيم العدد الكمي الفرعي المقابلة (l):

هذه القيم لـ “l” تمثل أنواعًا مختلفة من المدارات الفرعية أو المدارات داخل مستوى الطاقة الرئيسي
العدد الكمي المغناطيسي (m_l)
-هذا العدد الكمي يُحدد توجيه المدار في الفضاء.
-يحدد عدد المدارات من نوع معين (المعطى بواسطة “l”) )واتجاهاتها الفضائية.
-العدد الكمي المغناطيسي، المرمز إلى m_l، هو واحد من أربعة أعداد كمية تصف الحالة الكمية لإلكترون في ذرة.
-يحدد توجيه المدار الإلكتروني داخل قشرة فرعية معينة أو مستوى فرعي محدد بواسطة العدد الكمي الفرعي (l).
بعبارة أخرى، يوفر معلومات حول البعد الفضائي لسحابة احتمال الإلكترون داخل قشرة فرعية.
|
المستوى الفرعي |
عدد المجالات(الاوربيتال) |
|
s |
1 |
|
p |
3 |
|
d |
5 |
|
f |
7 |
أمثلة:
بالنسبة لكل قيمة من “L”، هناك (2L+1 ) قيمة ممكنة لـ m_l .
على سبيل المثال، إذا كانت L = 1
يعني المدارالفرعي (p) يمكن أن يكون قيمة m_l هو ]-1، 0، أو 1 [، مما يشير إلى ثلاث اتجاهات مختلفة للمدارp.
القيم: قيم m_l تتراوح بين -l و+l، بما في ذلك الصفر، وتمثل التوجيهات الفضائية المختلفة أو المستويات المغناطيسية داخل غلاف طاقة معين.
أمثلة:
فيما يلي بعض الأمثلة لتوضيح مفهوم العدد الكمي المغناطيسي:
L = 0 تعني وجود الغلاف الفرعي s):)
إذا كانت l = 0 تعني الغلاف الفرعي S، فتكون قيمة m_l له هي قيمة واحد هي الصفر فقط.
وهذا يعني وجود بعد فضائي واحد أو مدار كروي واحد داخل الغلاف الفرعي s

إذا كان L=1 يعني الغلاف الفرعي p
وتكون قيمة m_l له تأخذ ثلاث قيم: -1، 0، و+1. وهذا يمثل ثلاث أبعاد فضائية لمدارات p على طول محاور x، y، و z.
إذا كانت L = 2 يعني الغلاف الفرعي d) )،
يمكن لـ m_l أن يأخذ خمس قيم:] -2، -1، 0، +1، و+2.[
وهذا يمثل خمس اتجاهات فضائية لمدارات d داخل الغلاف الفرعي d .
يأخذ شكل كمثريتين متقابلتين عند الرأس

في الختام، يوفر العدد الكمي المغناطيسي (m_l) معلومات حول الاتجاهات أو الأبعاد الفضائي لمدارات الإلكترون داخل المستويات الفرعية وهو جزء مهم من الوصف الكمي الميكانيكي للسلوك الذري والجزيئي.
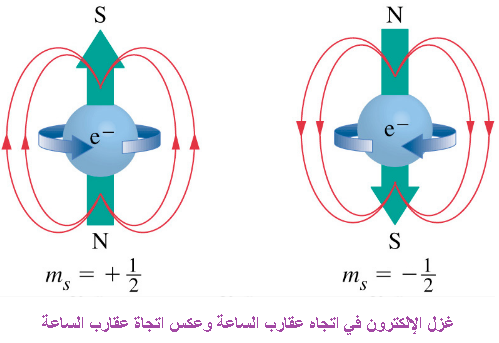
العدد الكمي المغزلي للدوران (m_s)
-العدد الكمي للدوران يُمثل الدوران الحقيقي للإلكترون
-يمكن أن تكون للإلكترونات إحدى قيمين ممكنتين للدوران: +1/2 أو -1/2، ويُعرفان على أنهما “دوران لأعلى” و “دوران لأسفل” على التوالي.
-دوران الالكترون في اتجاه عقارب الساعة ويأخذ القيمة) (+1/2) وعكس اتجاه عقارب الساعة(-1/2 )
-
الحركة المغزلية للالكترون - -لا يتعلق هذا المعامل بوضع الإلكترون في الذرة ولكنه أساسي لمبدأ استبعاد بولي، الذي ينص على :
“أنه لا يمكن لاثنين من الإلكترونات في ذرة أن يكون لديهما نفس مجموعة الأعداد الكمية الأربعة “.
ما العلاقة بين أعداد الكم الأربعة؟

– العدد الكمي الرئيسي (n) يحدد مستوى الطاقة ويتعلق بالمسافة المتوسطة للإلكترون عن النواة.
-العدد الكمي الفرعي الزاوي (l) متعلق بشكل المدار الإلكتروني داخل ذلك المستوى الطاقي (n) .
-العدد الكمي المغناطيسي (m_l) يُحدد توجيه المدار في الفضاء ويمكن أن يأخذ قيمًا من -l إلى +l .
-العدد الكمي المغزلي للدوران (m_s) هو إما +1/2 أو -1/2 ويصف الدوران الجوهري للإلكترون .
-يمكن للإلكترونات ذات القيم المعاكسة للدوران أن تحتل نفس المدار .
في الختام، توفر الأعداد الكمية وصفاً شاملاً للحالة الكمية للإلكترونات في الذرة، مما يمكننا من فهم مستويات طاقتها وأشكال مداراتها وتوجيهاتها وسلوك الدوران ضمن الهيكل الذري.
العلاقة بين العدد الكمي الرئيسي والعدد الكمي الفرعي (l):
العدد الكمي الرئيسي (n) والعدد الكمي الفرعي (l) مترابطين حيث يحدد العدد الكمي الرئيسي مستوى الطاقة (القشرة) التي يتواجد فيها الإلكترون، والعدد الكمي الفرعي يحدد شكل المدار الإلكتروني داخل تلك المستوى الطاقي. فيما يلي كيفية ارتباطهم:
العدد الكمي الرئيسي (n):
يُمثل المستوى الرئيسي للطاقة أو القشرة الرئيسية للإلكترون.
يحدد الطاقة الكلية للإلكترون.
يعرف الحد الأقصى لعدد القشور الفرعية (المستويات الفرعية) داخل مستوى الطاقة.
القيم الممكنة لـ “n” هي أعداد صحيحة موجبة 1، 2، 3، 4، ….
العدد الكمي الفرعي (l):
المعروف أيضًا باسم العدد الكمي للزخم الزاوي .
يحدد شكل المدار الإلكتروني داخل مستوى طاقة معين (n) .
يحدد نوع القشرة الفرعية أو المدار الفرعي .
القيم الممكنة لـ “l” تتراوح بين 0 و (n-1) .
l = 0 تتوافق مع قشرة فرعية s
l = 1 تتوافق مع قشرة فرعية p
l = 2 تتوافق مع قشرة فرعية d .
أمثلة:
العدد الكمي الرئيسي (n) = 1:
في المستوى الأول للطاقة (n = 1)، هناك قشرة فرعية واحدة فقط بـ “l = 0″، والتي تتوافق مع قشرة فرعية s لذا، داخل هذا المستوى الطاقي، هناك مدار s واحد فقط.
العدد الكمي الرئيسي (n) = 2:
في المستوى الثاني للطاقة (n = 2)، هناك قيمتان ممكنتان لـ “l” : 0 و 1.
عندما “l = 0″، يتوافق ذلك مع قشرة فرعية s، لذا يوجد مدار s واحد في هذا المستوى.
عندما “l = 1″، يتوافق ذلك مع قشرة فرعية p ، لذا هناك ثلاثة مدارات] px، py، pz [ في هذا المستوى.
العدد الكمي الرئيسي (n) = 3:
في المستوى الثالث للطاقة (n = 3)، هناك ثلاث قيم ممكنة لـ “l” : 0] ، 1، و 2.[
عندما “l = 0″، يتوافق ذلك مع قشرة فرعية s، لذا يوجد مدار s واحد .
عندما “l = 1″، يتوافق ذلك مع قشرة فرعية p، لذا هناك ثلاثة مدارات p.
عندما “l = 2″، يتوافق ذلك مع قشرة فرعية d، لذا يوجد خمسة مدارات d .
توضح هذه الأمثلة كيف يتم تحديد قيم العدد الكمي الفرعي (l) بواسطة العدد الكمي الرئيسي (n) وكيف تحدد مجموعة متنوعة من أشكال المدارات واتجاهاتها داخل كل مستوى طاقة. العلاقة بين “n” و “l” هي جوهرية لفهم توزيع الإلكترونات في الذرات.
الفرق في الطاقة بين المستويات الفرعية في كل مستوى رئيسي:
-الطاقة للمستويات الفرعية داخل مستوى طاقة رئيسي ليست نفسها .
-المستويات الفرعية داخل مستوى طاقة معين لها طاقات مختلفة، وهذا الفارق في الطاقة ناتج عن السلوك الكمي الميكانيكي للإلكترونات في الذرات.
-تعتمد ترتيب الطاقة للمستويات الفرعية على قيمة العدد الكمي الفرعي (l)
– يتبع ترتيب الطاقة للمستويات الفرعية داخل مستوى طاقة رئيسي معين هذا النمط:
-مستوى فرعي s (l = 0): هذا هو أدنى مستوى فرعي من حيث الطاقة داخل المستوى الطاقي .
-مستوى فرعي p (l = 1): مستوى فرعي p يكون أعلى في الطاقة مقارنة بالمستوى الفرعي s .
-مستوى فرعي d (l = 2): مستوى فرعي d يكون أعلى في الطاقة مقارنة بالمستويين الفرعيين s و p .
-مستوى فرعي f (l = 3): مستوى فرعي f يكون أعلى في الطاقة مقارنة بالمستويات الفرعية s و p و d .
والفارق في الطاقة بين هذه المستويات الفرعية يزيد مع قيمة العدد الكمي الفرعي (l) .
على سبيل المثال، داخل المستوى الطاقي الثالث (n = 3)، ترتيب الطاقة للمستويات الفرعية هو كما يلي:
3s (l = 0) < 3p (l = 1) < 3d (l = 2) < 3f (l = 3)
لذا، الفارق في الطاقة بين 3s و 3p أصغر من الفارق في الطاقة بين 3p و 3d، وهكذا.
من المهم أن نلاحظ أن مستويات الطاقة نفسها أيضًا مختلفة، حيث تكون المستويات الطاقية الرئيسية الأعلى في الطاقة مقارنة بالمستويات الأدنى.
ومع ذلك، تحدد الفروق الطاقية الرئيسية بين المستويات الفرعية أساسًا بقيمة العدد الكمي الفرعي (l).
سعة مستويات الطاقة الفرعية بالإلكترونات
تحدد سعة المستويات الفرعية، التي تشير إلى الحد الأقصى لعدد الإلكترونات التي يمكن أن تحتل مستوى فرعي معين، بواسطة القواعد التالية:
مستوى فرعي s: يحتوي مستوى فرعي s على مدار واحد، ويمكن لكل مدار استيعاب حد أقصى قدره 2 إلكترون. لذلك، يمكن لمستوى فرعي s أن يحتوي على حد أقصى 2 إلكترون.
مستوى فرعي p: يحتوي مستوى فرعي p على ثلاثة مدارات، ويمكن لكل مدار استيعاب حد أقصى قدره 2 إلكترون. لذلك، يمكن لمستوى فرعي p أن يحتوي على حد أقصى 6 إلكترون (3 مدارات × 2 إلكترون لكل مدار ) .
مستوى فرعي d: يحتوي مستوى فرعي d على خمسة مدارات، ويمكن لكل مدار استيعاب حد أقصى قدره 2 إلكترون. لذلك، يمكن لمستوى فرعي d أن يحتوي على حد أقصى 10 إلكترون (5 مدارات × 2 إلكترون لكل مدار) .
مستوى فرعي f: يحتوي مستوى فرعي f على سبعة مدارات، ويمكن لكل مدار استيعاب حد أقصى قدره 2 إلكترون. لذلك، يمكن لمستوى فرعي f أن يحتوي على حد أقصى 14 إلكترون (7 مدارات × 2 إلكترون لكل مدار ) .
تعتمد هذه القواعد على مبدأ استبعاد بولي، الذي ينص على أنه لا يمكن لاثنين من الإلكترونات في الذرة أن تمتلك نفس مجموعة الأعداد الكمية (بما في ذلك نفس قيم n و l و m_l و m_s)). ونتيجة لذلك، تُحدد سعة كل مستوى فرعي بعدد المدارات التي يحتوي عليها والحد الأقصى لعدد الإلكترونات التي يمكن لكل مدار أن يستوعبه.
ما هي القيم المحتملة للرقم الكمي المغناطيسي (ml) عندما l=1؟
عندما يكون العدد الكمي الفرعي (l) يساوي 1، تتراوح القيم المحتملة للرقم الكمي المغناطيسي (m_l) من -1 إلى +1، بما في ذلك الصفر .
القاعدة لتحديد هذه القيم هي كالتالي:
-l ≤ m_l ≤ l
لـ l = 1:
القيم المسموح بها لـ m_l هي -1، 0، و +1.
لذا، عندما l = 1، القيم المحتملة لـ m_l هي -1، 0، و +1، تمثل ثلاث توجيهات مكانية مختلفة لمدارات مستوى فرعي p.
ما هي القيم المحتملة للرقم الكميالمغناطيسي (ml) عندما l=2؟
عندما يكون العدد الكمي الفرعي (l) يساوي 2، تتراوح القيم المحتملة للرقم الكميالمغناطيسي (m_l) من -2 إلى +2، بما في ذلك الصفر.
القاعدة لتحديد هذه القيم هي كالتالي:
-l ≤ m_l ≤ l
لـ l = 2:
القيم المسموح بها لـ m_l هي -2، -1، 0، +1، و +2.
لذا، عندما l = 2 ، القيم المحتملة لـ m_l هي -2، -1، 0، +1، و +2، تمثل خمس توجيهات مكانية مختلفة لمدارات مستوى فرعي d .
ما هي القيم المحتملة للرقم الكمي المغناطيسي (ml) عندما l=3؟
عندما يكون العدد الكمي الفرعي (l) يساوي 3، تتراوح القيم المحتملة للرقم الكميالمغناطيسي (m_l) من -3 إلى +3، بما في ذلك الصفر.
القاعدة لتحديد هذه القيم هي كالتالي:
-l ≤ m_l ≤ l
لـ l = 3:
القيم المسموح بها لـ m_l هي -3، -2، -1، 0، +1، +2، و +3.
لذا، عندما l = 3، القيم المحتملة لـ m_l هي -3، -2، -1، 0، +1، +2، و +3، تمثل سبع توجيهات مكانية مختلفة لمدارات مستوى فرعي f .
اختبار تحصيلي لتثبيت المعلومات الواردة في الدرس
اختبار حول أعداد الكم الأربعة
السؤال 1: اكتب تعريفًا للعدد الكمي الرئيسي (n) واشرح كيف يمثل هذا العدد المستوى الرئيسي للطاقة في الذرة.
السؤال 2: قدم أمثلة على العدد الكمي الرئيسي (n) للمستويات الأولى الأربعة في الذرة.
السؤال 3: استخدم الصيغة الخاصة بحساب عدد الإلكترونات في الغلاف (n) وقدم العدد الأقصى للإلكترونات في المستويات الرئيسية الأولى (n).
السؤال 4: لماذا لا يتم تطبيق صيغة (number of electron) = 2n^2 على المستوى الأعلى من المستوى الرابع؟
السؤال 5: شرح كيف تتغير طاقة مستويات الطاقة في الذرة بمرور الوقت.
السؤال 6: ما هو العدد الكمي الثانوي الفرعي (l)؟ وكيف يؤثر هذا العدد على شكل المدارات الإلكترونية؟
السؤال 7: أعطِ أمثلة على القيم الممكنة للعدد الكمي الثانوي الفرعي (l) والأغلفة الفرعية المقابلة لها.
السؤال 8: ما هو العدد الكمي الرئيسي والعدد الكمي الثانوي الفرعي للإلكترون في الغلاف (n=3، l=2)؟
السؤال 9: اشرح كيف يساعد العدد الكمي الثانوي الفرعي في تحديد بنية سحابة الإلكترون حول النواة.
السؤال 10: ما هي التحديات التي تواجه تحديد توزيع الإلكترونات في المستويات الطاقية الأعلى من المستوى الرابع؟
السؤال 11: كيف يمكن استخدام أعداد الكم الأربعة في فهم البنية الإلكترونية للذرات والتنبؤ بسلوكها الكيميائي؟
الإجابات
الإجابات:
السؤال 1:العدد الكمي الرئيسي (n) هو عبارة عن رقم يُمثل المستوى الرئيسي للطاقة أو الغلاف الذي يتواجد فيه الإلكترون. يصف بعد الإلكترون عن النواة.
السؤال 2:
لـ n = 1: المستوى الأول (K).
لـ n = 2: المستوى الثاني (L).
لـ n = 3: المستوى الثالث (M).
لـ n = 4: المستوى الرابع (N).
السؤال 3:
عدد الإلكترونات في الغلاف (n) = 2n^2.
لـ n = 1: 2 إلكترون.
لـ n = 2: 8 إلكترونات.
لـ n = 3: 18 إلكترونًا.
لـ n = 4: 32 إلكترونًا.
السؤال 4:
لأن الذرة تصبح غير مستقرة عندما يزيد عدد الإلكترونات عن 32 إلكترونًا.
السؤال 5:
تزيد طاقة مستويات الطاقة في الذرة عندما نبتعد عن النواة، ويكون للإلكترونات في أدنى مستويات الطاقة طاقة أقل.
السؤال 6:
العدد الكمي الثانوي الفرعي (l) يحدد شكل المدار الإلكتروني داخل المستوى الطاقي، ويتراوح قيمه بين 0 و (n-1).
السؤال 7:
لـ l = 0: تتوافق مع مدار s.
لـ l = 1: تتوافق مع مدار p.
لـ l = 2: تتوافق مع مدار d.
لـ l = 3: تتوافق مع مدار f.
السؤال 8:
n=3، l=2. الإلكترون في الغلاف (n=3) والمدار الفرعي (l=2) يتواجد في المدار d.
السؤال 9:العدد الكمي الثانوي الفرعي يساعد في تحديد شكل المدارات الإلكترونية واتجاهاتها داخل المستوى الطاقي.
السؤال 10:تحديد توزيع الإلكترونات في المستويات الطاقية الأعلى يواجه تحديات بسبب التأثيرات المعقدة للإلكترونات عندما نتجاوز المستوى الرابع.
السؤال 11:يمكن استخدام أعداد الكم الأربعة لفهم البنية الإلكترونية للذرات والتنبؤ بسلوكها الكيميائي من خلال فهم توزيع الإلكترونات في المدارات.
اختبار 2
اختبار عن العدد الكمي المغناطيسي (m_l) والعدد الكمي المغزلي (m_s)
السؤال 1: مفهوم العدد الكمي المغناطيسي (m_l)
ما هو دور العدد الكمي المغناطيسي (m_l) في وصف حالة الإلكترون داخل الذرة؟
الجواب:يُستخدم العدد الكمي المغناطيسي (m_l) لتحديد توجيه المدار الإلكتروني داخل قشرة فرعية معينة وتحديد الاتجاهات الفضائية لمدارات الإلكترون.
السؤال 2: القيم الممكنة لـ m_l بناءً على قيم L
- إذا كانت قيمة L = 2، فما هي القيم الممكنة لـ m_l؟
الجواب:إذا كانت قيمة L = 2 (الغلاف الفرعي d)، يمكن لـ m_l أن تأخذ القيم: -2، -1، 0، +1، و+2.
السؤال 3: العلاقة بين m_l واتجاهات المدار
- كيف يمكن لقيم m_l أن تُفسر بالنسبة لاتجاهات المدارات الفضائية؟
الجواب:قيم m_l تُفسر الاتجاهات الفضائية لمدارات الإلكترون داخل الغلاف الفرعي، حيث تمثل قيم m_l الاتجاهات المختلفة للمدارات على طول محاور x، y، و z.
السؤال 4: العدد الكمي المغزلي للدوران (m_s)
- ما هو دور العدد الكمي المغزلي للدوران (m_s) في نظرية الكم؟
الجواب:
يُمثل العدد الكمي المغزلي للدوران (m_s) الدوران الحقيقي للإلكترون، حيث يكون للإلكترون إحدى قيمتين ممكنتين: +1/2 أو –
1/2، تُعرفان على أنهما “دوران لأعلى” و “دوران لأسفل” على التوالي.
السؤال 5: مبدأ استبعاد بولي
- كيف يساهم معامل الدوران (m_s) في مبدأ استبعاد بولي؟
الجواب:
مبدأ استبعاد بولي ينص على أن لا يمكن لاثنين من الإلكترونات في ذرة أن يكون لديهما نفس مجموعة الأعداد الكمية الأربعة. معامل الدوران
(m_s) يسهم في هذا المبدأ، حيث يُسمح لكل إلكترون بأن يكون لديه قيمة مختلفة لـ m_s، مما يسهم في تحقيق التنويع في مجموعة الإلكترونات في الذرة.
السؤال 6: التفاعل بين m_l و m_s
- هل هناك أي علاقة بين قيم العددين الكميين m_l و m_s؟ إذا كان الأمر كذلك، فحدد العلاقة.
الجواب:
على الرغم من أن m_l و m_s هما عددين كميين مختلفين، إلا أن قيم m_l لا تتأثر بقيم m_s والعكس صحيح. يعني ذلك أن
القيم الممكنة لـ m_l لا ترتبط بشكل مباشر بالقيم الممكنة لـ m_s.
السؤال 7: الاستنتاج
- ما الدور الذي يلعبه العدد الكمي المغناطيسي (m_l) ومعامل الدوران (m_s) في فهم سلوك الإلكترونات داخل الذرة؟
الجواب:
العدد الكمي المغناطيسي (m_l) يحدد توجيه المدار والاتجاهات الفضائية للإلكترونات في الذرة، بينما معامل الدوران (m_s) يسهم
في مبدأ استبعاد بولي ويعبر عن الدوران الحقيقي للإلكترون.
هذه الإجابات تعتبر إشارات عامة، يمكن توسيعها بمزيد من التفصيل والأمثلة حسب الحاجة.
