الطيف الذري للانبعاث، نموذج بور الذري، والنظرية الذرية الحديثة
Contents
الطيف الذري للانبعاث، نموذج بور الذري، والنظرية الذرية الحديثة
:Atomic emission spectra, Bohr’s atomic model and modern atomic theory
الطيف الذري للانبعاث، نموذج بور الذري، والنظرية الذرية الحديثة
استكشف عالم التركيب الذري والميكانيكا الكمية بطريقة مثيرة. تعرف على نماذج الذرات، وسلوك الإلكترونات، ومبادئ الكم، ونظرية الميكانيكا الموجية للذرة. احصل على رؤى حول المدارات، والأعداد الكمية، ومبدأ عدم التأكد لهايزنبرج. اكتشف مزايا ونقائص النماذج الذرية واكتسب فهمًا للنظرية الذرية الحديثة.
الطيف الذري للانبعاث، المعروف أيضًا باسم الطيف الخطي أو الطيف الذري للانبعاث، هي أنماط من خطوط الضوء المتميزة والمتقطعة التي تنبعث من الذرات عندما تنتقل من حالات مثارة إلى حالات طاقة أدنى.
هذه الطياف ضرورية لفهم البنية الإلكترونية وسلوك الذرات.
فيما يلي النقاط الرئيسية حول الطيف الذري للانبعاث:
مستويات الطاقة:
في الذرات، تحتل الإلكترونات مستويات طاقة مختلفة أو قشور.
هذه المستويات الطاقية هي مقننة، مما يعني أن لديها قيم طاقة محددة ومتقطعة.
التحفيز:Excitation
يمكن تحفيز الذرات عندما تمتص طاقة، غالبًا في شكل فوتونات (ضوء).
يؤدي هذا التحفيز إلى تحرك الإلكترونات إلى مستويات طاقة أعلى.
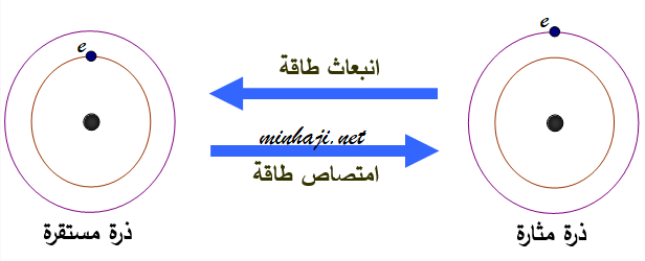
التحفيز العكسي:Excitation
عندما تعود الإلكترونات المثارة إلى مستويات الطاقة الأدنى، تطلق الطاقة الزائدة في شكل فوتونات، والتي يمكن مراقبتها كضوء.
الضوء المنبعث لديه طول موجات وطاقات متقطعة، والتي تتناسب مع اختلافات الطاقة بين المستويات المثارة والمستويات ذات الطاقة الأدنى.
الطيف الخطي:spectrum line
تتألف الطياف الذرية للانبعاث من خطوط طول موجة محددة، وغالبًا ما يكون ذلك مرئيًا في شكل خطوط ملونة على مطياف ضوء.
كل خط يتوافق مع انتقال إلكتروني معين بين مستويات الطاقة.
فريدة لكل عنصر:
كل عنصر لديه طيف ذري للانبعاث فريد.
أنماط الخطوط تشبه بصمةالاصابع للعنصر.
الطيف الخطي لذرة الهيدروجين
:The line spectrum of hydrogen atom

الطيف الخطي لذرة الهيدروجين هو واحد من أمثلة الأطياف الذرية للانبعاث الأكثر شهرة.
يتألف من سلسلة من خطوط متميزة ومتقطعة من الضوء التي تنبعث عندما تنتقل الإلكترونات في ذرة الهيدروجين بين مستويات طاقة مختلفة.
كان الطيف الخطي لذرة الهيدروجين حاسمًا في دراسة البنية الذرية ولعب دورًا هامًا في تطور الميكانيكا الكمية.
إليك بعض الميزات الرئيسية لطيف خطوط ذرة الهيدروجين:
سلسلة بالمر:
الجزء الأكثر شهرة وبارز في طيف خطوط الهيدروجين هو سلسلة بالمر.
تُمثل هذه السلسلة انتقالات الإلكترونات في الهيدروجين من مستويات طاقة أعلى إلى المستوى الطاقي الثاني (n = 2).
تقع الخطوط في سلسلة بالمر في المنطقة المرئية للطيف الكهرومغناطيسي.
أهم الخطوط في هذه السلسلة هي Hα، Hβ، Hγ، و Hδ، والتي تتناسب مع انتقالات من n = 3، 4، 5، و 6 إلى n = 2 على التوالي.
سلاسل لايمان وباشين: :Lyman and Paschen Series
للهيدروجين سلاسل أخرى من الخطوط في طيفه.
تُمثل سلسلة لايمان انتقالات الإلكترونات إلى المستوى الطاقي الأول (n = 1)، وتقع الخطوط في هذه السلسلة في منطقة الأشعة فوق البنفسجية.
تُمثل سلسلة باشين انتقالات الالكترونات إلى المستوى الطاقي الثالث (n = 3)، وتقع الخطوط في هذه السلسلة في منطقة الأشعة تحت الحمراء.
مستويات الطاقة: Energy Levels
تعتبر الخطوط في طيف الهيدروجين نتيجة للمستويات المقننة للطاقة في الذرة.
عندما تتحرك الإلكترونات بين هذه المستويات الطاقية، يتم إطلاق أو امتصاص فوتونات بطاقات تتناسب مع الفارق في الطاقة بين هذه المستويات.
الطول الموجي والطاقات:wavelength and energies
كل خط في طيف الهيدروجين يتوافق مع طول موجة محدد للضوء وطاقة معينة.
نموذج بور الذري Bohr s Atomic model
نموذج بور الذري، الذي اقترحه الفيزيائي الدنماركي نيلز بور في عام 1913، كان تقدمًا كبيرًا في فهمنا للبنية الذرية ولعب دوراً حاسماً في تطوير الميكانيكا الكمية. قدم هذا النموذج مفهوم المستويات المقننة للطاقة وشرح بنجاح الطيف الخطي للهيدروجين.
فيما يلي السمات والمبادئ الرئيسية لنموذج بور الذري:
نموذج بور افترض أن:
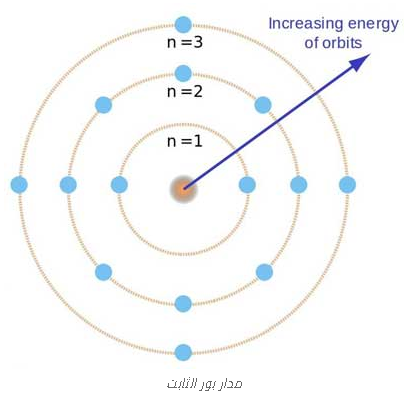
كمية مستويات الطاقة Quantization of Energy Levels:
-الإلكترونات في الذرة يمكن أن تكون موجودة فقط في مستويات طاقة محددة ومقننة أو مدارات.
يشار أيضاً إلى هذه المستويات الطاقية باسم الأغلفة الإلكترونية.
-يمكن للإلكترونات أن تنتقل بين هذه المستويات عن طريق امتصاص أو إطلاق الطاقة في شكل فوتونات.
مدارات الإلكترون: Electron Orbits
الإلكترونات تتحرك في مدارات دائرية حول النواة.
كل مدارة محدد بمستوى طاقة محدد.
كلما اقترب الإلكترون من النواة، زاد مستوى طاقته.
السرعة الزاوي الثابت:Fixed Angular Momentum
اقترح بور أن لدى الإلكترونات سرعةا زاويًا ثابتًا في مدورها.
وهذا يعني أنها تتحرك في مسارات ثابتة ومستقرة دون إطلاق إشعاع، وهو أمر كان يشكل مشكلة في نموذج رذرفورد التقليدي.
انبعاث الإشعاع: Radiation Emission
عندما تنتقل إلكترون من مستوى طاقة أعلى إلى مستوى أدنى، ينطلق فوتون طاقة.
طاقة الفوتون المنطلق تكون مساوية لفارق الطاقة بين المستويين، ويمكن حساب تردد وطول الموجة الخاصين به باستخدام ثابت بلانك وسرعة الضوء.
ثبات بعض المدارات: Stability of Certain Orbits
نموذج بور حدد أن بعض المدارات أكثر استقرارًا من غيرها. الإلكترونات في أدنى مستوى طاقة (n = 1) في المدار الأكثر استقرارًا، والانتقالات إلى هذا المدار تؤدي إلى إنطلاق فوتونات في منطقة الأشعة فوق البنفسجية، مكونة سلسلة لايمان للهيدروجين.
طيف الهيدروجين: Hydrogen Spectrum
واحدة من أهم إنجازات نموذج بور كانت قدرته على شرح الطيف الخطي للهيدروجين، بما في ذلك سلاسل بالمر، لايمان، وباشن.
تُمثل هذه السلاسل انتقالات الإلكترونات في الهيدروجين بين مستويات طاقة مختلفة.
قيود نموذج بور: Limitations of Bohr’s model
-كان نموذج بور ناجحًا في شرح ذرة الهيدروجين ولكن كان يعاني من قيود عند تطبيقه على الذرات التي تحتوي على أكثر من إلكترون واحد.
-لم يعالج بشكل كامل التفاعلات المعقدة بين الإلكترونات والنواة.
-يمكن أن يشرح طيف أي ذرة بشكل أقل مما في حالة الهيدروجين.
فرضيات بور: نقاط تتفق مع فرضيات رذرفورد
Bohr s Postulates :points that agree with Rutherford postulates
-تم تطوير نموذج نيلز بور الذري كتحسين على نموذج إرنست رذرفورد الذري الذي كان يعاني من بعض القيود.
-على الرغم من أن بور قدم مفاهيم وفرضيات جديدة للتغلب على هذه القيود، إلا أن نموذجه حافظ على بعض الأفكار الرئيسية من نموذج رذرفورد.
فيما يلي فرضيات نموذج بور التي تتفق مع فرضيات رذرفورد:
–النواة المركزية: Central Nucleus
كل من نموذج رذرفورد ونموذج بور يتفقان على وجود نواة مركزية مشحونة إيجابيًا في وسط الذرة.
كان نموذج رذرفورد هو الأول الذي اقترح أن معظم كتلة الذرة مركزة في النواة.
مدارات الإلكترون: Electron Orbits
يحتفظ نموذج بور بمفهوم الإلكترونات التي تتحرك حول النواة، على نحو مشابه لنموذج رذرفورد.
ومع ذلك، يقدم نموذج بور مستويات طاقة مقننة لهذه المدارات، على عكس المدارات المستمرة التي اقترحها رذرفورد.
كتلة وشحنة الإلكترون: Electron Mass and Charge
يعترف كل من النموذجين بأن للإلكترونات كتلة وشحنة سالبة.
كان نموذج رذرفورد من بين أوائل النماذج التي أقرت بوجود الإلكترونات في الهيكل الذري.
جاذبية الإلكترون للنواة: Electron-Nucleus Attraction
اقترح نموذج رذرفورد أن الإلكترونات تجذب إلى النواة المشحونة إيجابياً بسبب القوى الكهروستاتيكية.
يحتفظ نموذج بور بهذا المفهوم من جاذبية كهروستاتيكية، ولكنه يضيف فكرة أن الإلكترونات يمكن أن تكون موجودة فقط في بعض المدارات المستقرة.
إطلاق الإشعاع: Emission of Radiation
اقترح نموذج رذرفورد أنه مع حركة الإلكترونات حول النواة، ينبغي أن تطلق الإلكترونات إشعاعًا.
يعالج نموذج بور هذه المسألة بتفتيش فرضية أن الإلكترونات في المدارات المستقرة لا تطلق باستمرار إشعاعًا.
إنها تطلق أو تمتص الطاقة فقط عند الانتقال بين مستويات الطاقة.
من المهم أن نلاحظ أنه بينما يستند نموذج بور إلى أفكار رذرفورد ويعالج بعض نقاط الضعف فيه، إلا أنه يقدم مفاهيم جديدة وأساسية تتعلق بتكميم مستويات الطاقة واستقرار المدارات وشرح الطيف الخطي التي لم تكن جزءًا من نموذج رذرفورد.
لذلك، يمثل نموذج بور تقدمًا كبيرًا في فهمنا للبنية الذرية، ولكنه ينحرف أيضًا عن نموذج رذرفورد بطرق هامة.
فرضيات بور: نقاط جديدة Bohr s Postulates :new points
نموذج نيلز بور الذري قدم عدة فرضيات ومفاهيم جديدة لم تكن جزءًا من نموذج إرنست رذرفورد الذري السابق. كانت هذه الفرضيات الجديدة حاسمة في شرح الطيف الخطي للهيدروجين وتكميم مستويات الطاقة في الذرات.
فيما يلي أبرز الفرضيات الجديدة في نموذج بور الذري:
مستويات الطاقة المكممة: Quantized Energy Levels
اقترح بور أن الإلكترونات في الذرة يمكن أن تحتل فقط مستويات طاقة معينة أو مدارات.
هذه المستويات الطاقية هي مكممة، مما يعني أن لديها قيم طاقة متقطعة ومحددة تمامًا.
لا يُسمح للإلكترونات بالوجود في المنطقة بين مستويات الطاقة المحددة .
تكميم السرعة الزاوي: Angular Momentum Quantization
قدم بور مفهوم تكميم السرعة الزاوي للإلكترونات في نموذجه.
سرعة الزاوي للإلكترون في مدار معين هو مضاعف صحيح لثابت بلانك مقسومًا على 2π (h/2π).
يساعد هذا التكميم للسرعة الزاوي في تحديد المستويات المسموح بها من الطاقة وأقطار مدارات الإلكترون.
مدارات مستقرة: Stable Orbits
وفقًا لنموذج بور، تكون بعض مدارات الإلكترون أكثر استقرارًا من غيرها.
الإلكترونات في أدنى مستوى طاقة (n = 1) تكون في المدار الأكثر استقرارًا.
الإلكترونات في المدارات المستقرة لا تطلق إشعاعًا، والانتقالات إلى هذه المدارات تؤدي إلى إطلاق أو امتصاص الطاقة في شكل فوتونات.
إشعاع عند الانتقال: Radiation upon Transition
عندما ينتقل الإلكترون من مستوى طاقة أعلى إلى مستوى أدنى، يطلق فوتونًا بطاقة تكون مساوية لفارق الطاقة بين المستويين.
يمكن حساب تردد وطول موجة الفوتون المطلق باستخدام ثابت بلانك وسرعة الضوء.
شرح طيف الهيدروجين: Hydrogen Spectrum Explanation
-نجح نموذج بور في شرح الطيف الخطي للهيدروجين بنجاح، بما في ذلك سلاسل بالمر، لايمان، وباشن.
-تُمثل هذه السلاسل انتقالات الإلكترونات في الهيدروجين بين مستويات الطاقة المختلفة.
-تكميم مستويات الطاقة في نموذجه أدى إلى تفسير طول الموجات المتقطع والمحدد للخطوط الطيفية.
تتناسب مستويات الطاقة مع خطوط الطيف:
Energy Levels Correspond to Spectral Lines
-تتوافق كل خط طيفي في الطيف المنطلق للذرة مع انتقال من مستوى طاقة معين في الذرة.
-ترتبط المستويات الطاقية بشكل مباشر بالخطوط الطيفية المرصودة، مما يجعل من الممكن التنبؤ بطول الموجات وشرحها.
ومع ذلك، من المهم أن نلاحظ أن نموذج بور كان خطوة انتقالية في تطور الميكانيكا الكمومية، وتم تجاوزه لاحقًا بواسطة نماذج كمومية أكثر شمولاً، تقدمت بفهم أكثر اكتمالًا للبنية الذرية.
الذرة المثارة Excited atom
-الذرة المثارة هي ذرة في حالة طاقة أعلى من حالتها الأساسية.
-يحدث ذلك عندما تمتص الذرة طاقة، عادة في شكل فوتونات أو حرارة، ونتيجة لذلك، تتحرك إلكتروناتها إلى مستويات طاقة أعلى.
-عندما تنتقل الإلكترونات في ذرة إلى مستويات طاقة أعلى، يعتبر أنها في حالات مثارة.
مزايا نموذج بور The advantages of Bohr s model
نموذج بور الذري، على الرغم من أنه لم يعد أكثر وصفًا شاملاً للبنية الذرية، قدم العديد من المزايا والمساهمات في فهم الذرة عندما تم اقتراحه.
تلك المزايا شملت:
-شرح طيف الهيدروجين:
نجح نموذج بور بنجاح في شرح الطيف الخطي للهيدروجين، بما في ذلك سلاسل بالمر، لايمان، وباشن.
كانت هذه إنجازًا هامًا لأنها قدمت نموذجًا مكممًا لمستويات الطاقة الذرية يمكن أن يشرح الطول الموجي المتقطع الملاحظ للخطوط الطيفية.
-تكميم مستويات الطاقة: Quantization of Energy Levels
قدم بور مفهوم تكميم مستويات الطاقة للإلكترونات في الذرات. هذه الفكرة وضعت أسسًا لتطوير الميكانيكا الكمية وكانت انحرافًا هامًا عن الفيزياء الكلاسيكية. وقدمت إطارًا لفهم الطبيعة المتقطعة لمستويات الطاقة الذرية وسلوك الإلكترونات.
مدارات مستقرة: Stable Orbits
قدم نموذج بور فكرة أن بعض مدارات الإلكترون تكون أكثر استقرارًا من غيرها.
الإلكترونات في المدارات المستقرة لا تطلق إشعاعًا، مما يعالج مشكلة في نموذج رذرفورد. ساعدت هذه الفكرة في شرح سبب عدم اندفاع الإلكترونات نحو النواة، كما كانت تقترحه نظرية الكهرومغناطيسية الكلاسيكية.
عيوب نموذج بور Inadequacies of Bohr s model
فيما يلي بعض العيوب الرئيسية في نموذج بور:
-قدرة محدودة على التطبيق: تم تطوير نموذج بور في المقام الأول للذرات شبيهة بالهيدروجين، التي تحتوي على إلكترون واحد. لم يكن قادرًا على وصف سلوك الذرات التي تحتوي على أكثر من إلكترون واحد، مثل الهيليوم، الذي يظهر تفاعلات معقدة بين الإلكترونات.
فشل في شرح البنية الدقيقة:
لم يُحسب نموذج بور للهيكل الدقيق للخطوط الطيفية المرصودة في تجارب أكثر تفصيلاً.
عدم شرح لدوران الإلكترون:
مبدأ عدم اليقين أو عدم التأكد:
لم يأخذ نموذج بور في اعتباره مبدأ عدم اليقين لهايزنبرغ، وهو مفهوم أساسي في الميكانيكا الكمية.
ينص هذا المبدأ على أنه من المستحيل معرفة مكان وسرعة جسيم بدقة في الوقت نفسه، وهو أمر له آثار كبيرة على سلوك الإلكترون.
ثنائية الموجة والجسيم: Wave-Particle Duality
عالج نموذج بور الإلكترونات بصفة حصرية كجسيمات تتبع مدارات كلاسيكية، متجاهلاً سلوكها المشابه للموجة، كما يوصفه المعادلة شرودينغر في الميكانيكا الكمية.
في ختام الأمر، قدم نموذج بور إسهامات كبيرة في فهم البنية الذرية وكممة الطاقة. ومع ذلك، أصبحت عيوبه وقيوده واضحة عند تطبيقه على ذرات أكثر تعقيداً ونطاق أوسع من الظواهر. وقد استُبدل بواسطة الميكانيكا الكمومية، التي قدمت إطارًا أكثر اكتمالًا ودقة لوصف سلوك الإلكترونات في الذرات والجزيئات.
مبدأ النظرية الذرية الحديثة (تعديل نموذج بور)
The principle of modern atomic theory (modification of Bohr s model)
النظرية الذرية الحديثة، المشار إليها في كثير من الأحيان بنظرية الكم الذري، هي تطور لنموذج نيلز بور الذري.
تضمنت مبادئ الميكانيكا الكمية وقدمت وصفًا أكثر شمولاً ودقة للبنية والسلوك الذري والجزيئي.
فيما يلي أبرز مبادئ النظرية الذرية الحديثة، التي يمكن اعتبارها تعديلات وتوسيعات لنموذج بور:
–ثنائية الموجة والجسيم: Wave-Particle Duality
الطبيعة المزدوجة للإلكترون The dual nature of electron
الجسيمات، بما في ذلك الإلكترونات، تظهر خصائصًا تشبه الجسيم وخصائص تشبه الموجة.
وهذا ما يعرف بثنائية الموجة والجسيم.
الإلكترونات يمكن وصفها بواسطة وظائف موجية تعطي توزيع احتمال مواقعها.
الإلكترونات هي جسيمات ذات كتلة وشحنة، وتتفاعل مع الجسيمات الأخرى من خلال القوى الكهروستاتيكية الكلاسيكية.
–الطبيعة الجسيمية: Particle-Like Nature
الإلكترونات هي جسيمات ذات كتلة وشحنة، وتتفاعل مع الجسيمات الأخرى من خلال القوى الكهروستاتيكية الكلاسيكية.
يمكن اكتشافها كنقاط منفصلة في التجارب، تمامًا كما هو الحال مع الجسيمات الكلاسيكية.
–الطبيعة الموجية: Wave-Like Nature
الإلكترونات تظهر أيضًا خصائص تشبه الموجة، كما يوصف بواسطة وظائفها الموجية في الميكانيكا الكمية.
تمثل وظيفة الموجة توزيع الاحتمالات للعثور على الإلكترون في مكان معين في الفضاء.
مبدأ عدم اليقين لهايزنبرغ: Heisenberg Uncertainty Principle
قدم بور فرضيات مفادها: “من الممكن تحديد كل من مكان وسرعة الإلكترون بدقة في نفس الوقت، ولكن عند تطبيق مبادئ الميكانيكا الكمومية.”
وخلص هايزنبرغ إلى أن:
“من المستحيل تحديد كل من سرعة وموقع الإلكترون في نفس الوقت عمليًا ولكن يمكن استخدام مصطلح ‘الاحتمال’، لأن حركة الموجة الإلكترونية لا تحدد موقعًا معينًا.”

المدارات الإلكترونية: Electron Orbitals
في النظرية الذرية الحديثة، يتم وصف الإلكترونات بأنها تحتل مناطق ثلاثية الأبعاد في الفضاء تُعرف باسم المدارات الإلكترونية.
تُمثل هذه المدارات توزيع الاحتمال للعثور على الإلكترون في موقع معين.
أشهر أنواع المدارات هي المدارات s و p و d و f.

سحب احتمال الإلكترون: :Electron Probability Clouds
تقدم النظرية الذرية الحديثة خرائط مفصلة لكثافة احتمال تواجد الإلكترون، تُظهر المناطق التي يُرجح وجود الإلكترون فيها أكثر. وغالبًا ما يُصوَّر هذه السحب على أنها رسوم كثافة الإلكترون.
هذه الطبيعة المزدوجة ضرورية لفهم سلوك الجسيمات الفرعية، مثل الإلكترونات.
نظرية الميكانيكا الموجية للذرة
The wave mechanical theory of the atom
نظرية الميكانيكا الموجية للذرة، المعروفة أيضًا باسم الميكانيكا الكمومية أو الفيزياء الكمية، هي نظرية أساسية تصف سلوك الجسيمات، خاصة الإلكترونات، على مستوى الذرة والذرة الفرعية.
قام العالم النمساوي شرودينغر (1926) بتطبيق فكرة بلانك وأينشتاين ودي بروجلي وهايزنبرغ لتأسيس:
نظرية الميكانيكا الموجية للذرة
-اشتقاق معادلة موجية يمكن أن تصف حركة الموجة الإلكترونية في الذرة
فيما يلي المبادئ والجوانب الرئيسية لنظرية الميكانيكا الموجية للذرة:
هذه الوظائف الموجية هي حلا لمعادلة شرودينغر، وهي معادلة أساسية في الميكانيكا الكمية.
كمّة مستويات الطاقة: تحديد المستويات المسموح بها
تقوم الميكانيكا الكمية بتكميم مستويات الطاقة للجسيمات في الذرة.
يتم وصف الإلكترونات بأنها موجودة في مستويات طاقة محددة، المعروفة أيضًا بالأغلفة الإلكترونية أو المدارات، والتي تتميز كل منها بقيم طاقة متميزة.
مبدأ عدم اليقين: Uncertainty Principle
تصف وظائف الموجة توزيع احتمالية العثور على جسيم في موقع معين وزمان معين.
بدلاً من المدارات الدائرية الثابتة للإلكترون، يُستخدم مفهوم سحابة الإلكترون للتعبير عن المنطقة في الفضاء حول النواة.
عند حل معادلة شرودينغر، يمكن أن يظهر:
بعض الاحتمالات والنتائج الرئيسية التي تنشأ عن حل معادلة شرودينغر تشمل:
مستويات الطاقة: Energy Levels
تعطي معادلة شرودينغر مجموعة من مستويات الطاقة المسموح بها للنظام.
هذه المستويات الطاقية تكون كمية، مما يعني أنها تأخذ قيمًا متفرقة ومحددة، وتتناسب مع الحالات الطاقية الممكنة للجسيمات داخل النظام.
المدارات الإلكترونية: Orbitals
تصف وظائف الموجة المستمدة من معادلة شرودينغر المدارات الإلكترونية.
تُمثل هذه المدارات المناطق في الفضاء حيث يُرجح وجود الإلكترونات.
سحابة الإلكترونات Electron cloud
هي المنطقة في الفضاء حول النواة حيث تكون احتمالية وجود الإلكترون في جميع الاتجاهات والمسافات (الأبعاد).
ملخص:
تتناول هذه الدرس عالم الهيكل الذري والميكانيكا الكمومية بشكل مثير. يشمل التطور التاريخي للنماذج الذرية، من نموذج رذرفورد إلى نموذج بور، ويقدم نظرية الميكانيكا الموجية للذرة. ستكتسب رؤى حول المدارات الإلكترونية والأعداد الكمومية ومبدأ عدم اليقين لهايزنبرغ. استكشف مزايا ونواقص النماذج الذرية وافهم مبادئ النظرية الذرية الحديثة. يوفر هذا الدليل الشامل أساسًا قويًا لفهم سلوك الجسيمات الفرعية والعالم الكمومي المعقد.
