تطور النماذج الذرية: من ديموكريتس إلى رذرفورد
Contents
تطور النماذج الذرية: من ديموكريتس إلى رذرفورد
Evolution of Atomic Models: From Democritus to Rutherford
تطور مفهوم البنية الذرية
استكشف الرحلة الشيقة لنظرية الذرات، من تأملات الإغريق القدماء إلى اكتشافات العلماء الحديثة مثل ديموكريتوس، دالتون، تومسون، ورذرفورد. تعرف على الفرضيات، والتجارب الرئيسية، والتطورات الرئيسية في النماذج الذرية.
لقد تطور مفهوم البنية الذرية بشكل كبير على مر القرون، من الأفكار الفلسفية المبكرة إلى نظرية الذرات الحديثة المدعومة بالأدلة التجريبية. إليك نظرة عامة على أبرز النقاط المهمة في تطور هذا المفهوم:
النظريات الفلسفية القديمة:
فلاسفة الإغريق القدماء، مثل لوكيبوس وديموكريتوس (حوالي القرن الخامس قبل الميلاد)، قدموا فكرة وجود جسيمات لا يمكن تقسيمها تسمى “الذرات”.
كانوا يعتقدون أن جميع المادة مكونة من هذه الجسيمات الأساسية التي لا يمكن تقسيمها بشكل أدق.
نظرية دالتون الذرية (1803):
نظرية جون دالتون الذرية كانت بداية الفكر الذري الحديث.
اقترح أن العناصر تتألف من جسيمات صغيرة لا يمكن تقسيمها تُسمى الذرات، وأن التفاعلات الكيميائية تشمل إعادة ترتيب هذه الذرات.
اكتشاف الإلكترون (نهاية القرن التاسع عشر):
في نهاية القرن التاسع عشر، اكتشف ج. ج. تومسون الإلكترون من خلال التجارب على الأشعة الكاثودية.
هذا الاكتشاف أعطى دفعة قوية لفكرة الذرات كجسيمات غير قابلة للتقسيم وأدى إلى تطوير نموذج “البلم بودنغ”، حيث تم تضمين الإلكترونات في “بودنغ” مشحون إيجابياً.
نموذج رذرفورد النووي (1911):
أدى تجربة رذرفورد الشهيرة برقائق الذهب إلى استنتاج أن الذرات تحتوي في الغالب على فراغ كبير مع نواة صغيرة وكثيفة مشحونة إيجابيًا في الوسط.
شرح هذا النموذج تبديد الجسيمات ألفا عند مرورها بالنواة.
نموذج بور للذرة (1913):
قدم نيلز بور مفهوم مستويات الطاقة المكملة للإلكترونات في الذرة.
نموذجه شرح خطوط الطيف للهيدروجين ووفر إطارًا لفهم البنية الذرية.
الميكانيكا الكمية (عقد 1920):
تطوير الميكانيكا الكمية، بمساهمات من شرودنجر، هايزنبرغ، وغيرهم، غيّر فهمنا للبنية الذرية.
قدمت الميكانيكا الكمية مفهوم الثنائية الموجية-جسيمية، ومبدأ عدم اليقين، والدوال الموجية لوصف سلوك الإلكترونات في الذرات.
نموذج السحابة الإلكترونية (النظرية الذرية الحديثة):
النظرية الذرية الحديثة، استنادًا إلى الميكانيكا الكمية، تصف الإلكترونات بأنها موجودة في سحب إلكترونية أو مدارات محيطية بدلاً من مدارات ثابتة.
هذه المدارات تحدد احتمالية العثور على إلكترون في منطقة معينة حول النواة.
لقد كان هذا النموذج ناجحًا بشكل كبير في شرح سلوك الذرات وخصائصها الكيميائية.
اكتشاف الجسيمات الفرعية:
شهد التقدم في علم الجسيمات اكتشاف مجموعة متنوعة من الجسيمات الفرعية، مثل البروتونات والنيوترونات وأنواع متعددة من الكواركات، والتي تشكل نواة الذرات.
فكرة ديموكريتس (فلاسفة الإغريق القدماء) عن تركيب الذرة
ديموكريتس، فيلسوف إغريقي قديم عاش في القرن الخامس قبل الميلاد، يُنسب له غالبًا تطوير نظرية ذرية مبكرة. أفكاره حول الذرات وضعت أسس نظرية الذرات الحديثة.
وفيما يلي بعض الجوانب الرئيسية لأفكار ديموكريتس حول الذرات:
الذرية: اقترح ديموكريتوس أن جميع المادة تتكون من جسيمات صغيرة ولا يمكن تقسيمها تُسمى “الذرات“. كلمة “ذرة” نفسها مشتقة من الكلمة اليونانية “أتوموس“، والتي تعني “غير قابل للتقسيم“.
عدد لا نهائي من الذرات: كان ديموكريتوس يعتقد أن الذرات كانت لا نهائية في العدد وتأتي بأشكال وأحجام مختلفة. كان يعتقد أن الاختلافات في المواد المجهرية كانت ناتجة عن تغييرات في ترتيبات وخصائص هذه الذرات.
غير قابلة للتدمير وأبدية: أكد ديموكريتوس أن الذرات لا يمكن تدميرها وهي أبدية.
لا يمكن إنشاؤها أو تدميرها ولكن يمكن لها الجمع والانفصال لتشكيل مواد مختلفة.
الفراغ (الفراغ): افترض ديموكريتوس أيضًا وجود الفراغ أو الفضاء الفارغ بين الذرات. ساعد هذا المفهوم في شرح حركة وتفاعل الذرات.
حركة الذرات: اقترح ديموكريتوس أن الذرات كانت في حالة مستمرة من الحركة.
و كانت تفاعلاتها واصطداماتها مسؤولة عن تكوين المادة.
من المهم أن نلاحظ أن أفكار ديموكريتوس الذرية كانت في الغالب فلسفية وناقصة الأدلة التجريبية. لم يكن لديه وصول إلى الأدوات والتقنيات المتقدمة التي يعتمد عليها العلم الحديث. ومع ذلك، أفكاره أشارت إلى انحراف كبير عن الفكر الإغريقي القديم السائد الذي اعتبر المادة متصلة وقابلة للتقسيم إلى مالا نهاية.
تم اكتشاف مفاهيم ديموكريتوس الذرية وتوسيعها من قبل العلماء في القرون اللاحقة، خاصة من قبل جون دالتون وعلماء حديثين آخرين. شملت هذه التطورات لاحقة أدلة تجريبية ووضعت أسس النظرية الذرية الحديثة التي نستخدمها اليوم.
أفكار أرسطو عن تركيب الذرة
كان أرسطو، الفيلسوف الإغريقي القديم الذي عاش في القرن الرابع قبل الميلاد، له تأثير كبير على الفلسفة والعلم في عصره.
كانت أفكاره حول طبيعة المادة وبنية الكون تتناقض مع النظرية الذرية المقترحة من قبل فيلسوف مثل ديموكريتوس.
وفيما يلي بعض الجوانب الرئيسية لأفكار أرسطو المتعلقة بطبيعة المادة والكون:
المادة مستمرة في التقسيم :أرسطو رفض مفهوم الجسيمات غير القابلة للتقسيم (الذرات) المقترحة من قبل ديموكريتوس.
كان يعتقد أن المادة كانت متصلة وقابلة للتقسيم بلا نهاية. وفقًا لأرسطو، كان من الممكن تقسيم أي مادة إلى أجزاء أصغر وأصغر إلى مالا نهاية.
أربعة عناصر أساسية:
اقترح أرسطو أن جميع المادة تتألف من أربعة عناصر أساسية:
التراب والماء والهواء والنار.
كانت لهذه العناصر خصائص وصفات طبيعية تحدد سلوك المادة.
فكرة بويل :Boyle s idea
كان العالِم الإيرلندي روبرت بويل (1627-1691) شخصية بارزة في تاريخ الكيمياء والفيزياء الحديثة.
وفيما يلي بعض الجوانب الرئيسية لأفكار بويل وإسهاماته:
العناصر الكيميائية:
هي مادة بسيطة نقية لا يمكن تحويلها إلى أشكال أبسط بواسطة الأساليب الكيميائية التقليدية.
شكك في مفهوم العناصر الأربعة الكلاسيكية (الأرض والماء والهواء والنار) ودعم وجود العناصر الكيميائية.
أكد على أهمية التجارب التجريبية ورفض الآرسطوية لرؤية العالم الطبيعي في ثورة العلم في القرن السابع عشر.
نموذج دالتون للذرة Dalton ‘s model of the atom
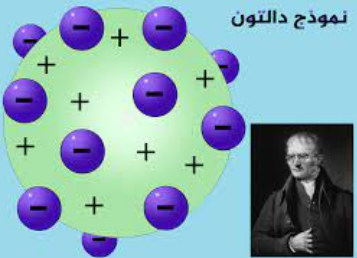
نموذج جون دالتون الذري، المقترح في أوائل القرن التاسع عشر، كان خطوة هامة في تطوير نظرية الذرات الحديثة.
استند نموذج دالتون إلى مزيج من الأدلة التجريبية والتأمل الدقيق، وضم عدة أفكار رئيسية:
الذرات غير قابلة للتقسيم: اقترح دالتون أن جميع المادة تتكون من جسيمات غير قابلة للتقسيم تسمى الذرات. واقترح أن الذرات هي أصغر وحدات الطبيعة ولا يمكن تقسيمها بشكل أدق.
بقاء الكتلة: كانت إحدى إسهامات دالتون الهامة هي مفهوم الحفاظ على الكتلة. أكد أنه في التفاعلات الكيميائية، لا تُخلق الذرات ولا تُدمر. بدلاً من ذلك، تعيد ترتيب نفسها لتشكيل مركبات جديدة. يُعرف هذا المبدأ الآن باسم قانون الحفاظ على الكتلة.
عناصر مختلفة، ذرات مختلفة: أدرك دالتون أن العناصر المختلفة تتكون من أنواع مختلفة من الذرات. لكل عنصر نوع فريد من الذرات له كتلة وخصائص كيميائية محددة.
ذرات نفس العنصر متطابقة: وفقًا لنموذج دالتون، الذرات من نفس العنصر متطابقة من حيث الحجم والكتلة والخصائص الكيميائية. ومع ذلك، تختلف ذرات العناصر المختلفة في خصائصها.
تكوين المركبات من تجميع الذرات: اقترح دالتون أن المركبات الكيميائية تتكون عندما تجتمع ذرات من عناصر مختلفة في نسب ثابتة وصف هذه التجمعات باستخدام نسب أعداد صحيحة بسيطة.
التفاعلات الكيميائية تشمل إعادة ترتيب الذرات: نموذج دالتون شرح التفاعلات الكيميائية على أنها إعادة ترتيب للذرات. الذرات تتجمع وتنفصل أو تعاود التجمع لتشكيل مركبات جديدة، مع الحفاظ على العدد الإجمالي للذرات في العملية.
أوزان ذرية: أدرك دالتون أن للذرات من عناصر مختلفة كتلًا مختلفة وأسند أوزان ذرية نسبية للعناصر استنادًا إلى نسبها في المركبات الكيميائية. بينما لم تكن هذه الأوزان الذرية دقيقة بالكامل، إلا أنها وضعت أسس الفكرة الحديثة للكتلة الذرية.
من المهم أن نلاحظ أن نظرية دالتون الذرية كانت مبتكرة، لكنها كانت تحمل بعض القيود والتقصير. على سبيل المثال، كان يعتقد أن الذرات من عنصر واحد لا يمكن أن تتحول إلى ذرات من عنصر آخر، وهو أمر يعرف الآن أنه ممكن من خلال التفاعلات النووية. بالإضافة إلى ذلك، تم تفنيد فكرة أن الذرات لا يمكن تقسيمها بعد ذلك مع اكتشاف الجسيمات دون الذرية مثل الإلكترونات والبروتونات والنيوترونات.
ومع ذلك، كان نموذج دالتون الذري تقدمًا كبيرًا في فهم طبيعة المادة، ولعب دورًا حاسمًا في تطوير نظرية الذرات الحديثة والجدول الدوري للعناصر.
اليك مثال على نظرية دالتون الذرية في العمل، مركزًا بشكل خاص على تكوين الماء (H2O) من عناصره المكونة، الهيدروجين (H) والأكسجين (O):
وفقًا لنظرية دالتون الذرية، يمكننا أن نفهم عملية تكوين الماء على النحو التالي:
الهيدروجين (H) والأكسجين (O) هم عناصر كيميائية مختلفة، ولكل منهما نوع محدد من الذرات.
الهيدروجين يتكون من ذرات هيدروجين (H) فقط، والأكسجين يتكون من ذرات أكسجين (O) فقط، وهذه الذرات هي متماثلة فيما بينها من حيث الحجم والكتلة والخصائص الكيميائية.
عندما يتفاعل الهيدروجين والأكسجين بنسبة 2:1 من حيث الأعداد (نسبة الذرات)، يتشكل الماء (H2O).
هذا التفاعل يشمل إعادة ترتيب الذرات. يتجمع ذرتي هيدروجين وذرة أكسجين لتكوين جزيء الماء (H2O). لا تخلق أو تدمر أي ذرات خلال هذا التفاعل، بل يتم فقط إعادة ترتيبها لتكوين مركب جديد.
هذا هو مثال عملي يظهر كيف يمكن استخدام نظرية دالتون لشرح كيفية تشكل الماء من الهيدروجين والأكسجين بناءً على مبادئها الأساسية حول الذرات وتفاعلها.
الذرات المائية والأكسجين:
وفقًا لنظرية دالتون الذرية، تتكون كل عنصر من ذرات متطابقة. الهيدروجين والأكسجين هما عنصرين متميزين يحملان ذراتهما الفريدة. ذرات الهيدروجين متماثلة بينها، وذرات الأكسجين أيضًا متماثلة بينها.
التفاعل الكيميائي:
عندما يتفاعل الهيدروجين والأكسجين كيميائيًا لتكوين الماء، يفعلون ذلك عن طريق الجمع بنسب ثابتة من الأعداد الصحيحة. في حالة الماء، نسبة الهيدروجين إلى الأكسجين هي 2:1، مما يعني أنه لكل ذرتي هيدروجين هناك ذرة واحدة من الأكسجين.
المعادلة الكيميائية:
المعادلة الكيميائية لتكوين الماء من الهيدروجين والأكسجين، بناءً على نظرية دالتون الذرية، هي كالتالي:
2H₂ (غاز الهيدروجين) + O₂ (غاز الأكسجين) → 2H₂O (الماء)
2H₂ (hydrogen gas) + O₂ (oxygen gas) → 2H₂O (water)
تمثل هذه المعادلة حقيقة أن جزيئتي غاز الهيدروجين (كل منهما يحتوي على ذرتي هيدروجين) تتفاعلان مع جزيء واحد من غاز الأكسجين (الذي يحتوي على ذرتي أكسجين) لتكوين جزيئين من الماء (كل منهما يحتوي على ذرتي هيدروجين وذرة واحدة من الأكسجين).
مبدأ بقاء الكتلة:Conservation of Mass
أحد المبادئ الرئيسية لنظرية دالتون الذرية هو مبدأ الحفاظ على الكتلة. وفقًا لهذا المبدأ، يجب أن تكون الكتلة الإجمالية للمواد الابتدائية متساوية للكتلة الإجمالية للمنتجات. في حالة تكوين الماء، تكون كتل ذرات الهيدروجين والأكسجين في المواد الابتدائية متساوية لكتل ذرات الهيدروجين والأكسجين في المنتجات.
إعادة ترتيب الذرات:
التفاعل الكيميائي الموجود أعلاه يشمل إعادة ترتيب الذرات. تُعيد ذرات الهيدروجين والأكسجين ترتيبها لتكوين جزيئات الماء، ولكن لا يتم إنشاء أو تدمير أي ذرات خلال هذه العملية، مما يتوافق مع نظرية دالتون الذرية.
لذلك، تقدم نظرية دالتون الذرية إطارًا لفهم كيفية تكوين الماء من عناصره المكونة، الهيدروجين والأكسجين، من خلال إعادة ترتيب الذرات بنسب ثابتة مع الحفاظ على الكتلة.
اكتشاف أشعة الكاثود: Discovery of cathode rays
اكتشاف أشعة الكاثود هو محطة مهمة في تطور الفيزياء الذرية والجسيمات الحديثة.
تم مشاهدة أشعة الكاثود ودراستها في بداية القرن التاسع عشر، مما أدى إلى رؤى هامة حول طبيعة الكهرباء، وسلوك الجسيمات المشحونة، وفهم الإلكترون في النهاية.
جي. جي. تومسون (أواخر القرن التاسع عشر):
قدم جي. جي. تومسون، الفيزيائي الإنجليزي، أهم المساهمات في فهمنا لأشعة الكاثود. باستخدام نسخة معدلة من أنبوب كروكس، أجرى تومسون تجارب أدت إلى استنتاج أن أشعة الكاثود كانت مكونة من جسيمات صغيرة مشحونة سالباً. وأطلق عليها تومسون اسم “الإلكترونات” وحسب نسبة الشحنة إلى الكتلة لها. عمل تومسون وضع أسس نموذجه “الكمثرى بالقمح” للذرة، والذي كان واحدًا من أوائل النماذج التي تضم الجسيمات النووية الدقيقة.
اكتشاف أشعة الكاثود والتعرف لاحقًا على الإلكترونات كجسيمات نووية دقيقة كانت خطوات حاسمة في تطوير النظرية الذرية الحديثة. لقد قدمت دليلًا على وجود الجسيمات النووية الدقيقة وأدت إلى فهم أفضل لبنية الذرات وسلوك الجسيمات المشحونة.
تجربة الأشعة الكاثودية لج. ج. تومسون
قامت تجربة الأشعة الكاثودية لج. ج. تومسون، التي أُجريت في أواخر القرن التاسع عشر، بدور رئيسي في فهمنا لأشعة الكاثود والجسيمات النووية الدقيقة.
إليك نظرة عامة على الجوانب الرئيسية لتجربة تومسون:
الهدف: الهدف الرئيسي لتجربة تومسون كان دراسة طبيعة وخصائص أشعة الكاثود، وتحديد ما إذا كانت مكونة من جسيمات وقياس خصائصها بشكل خاص.
التجهيزات: استخدم تومسون أنبوبًا كروكس معدلاً لإجراء تجربته. هذا الأنبوب يحتوي على أقطاب كاثودية وأقطاب أخرى موجبة.
الظاهرة المرصودة: أثناء تجربته، لاحظ تومسون أن هناك شعاعًا مشعًا من الأشعة السالبة (أشعة الكاثود) ينبعث من الكاثود ويتجه نحو الأقطاب الموجبة في الأنبوب.
النتائج: من خلال تجاربه، توصل تومسون إلى استنتاج أن هذا الشعاع المشع من الأشعة الكاثودية يتألف من جسيمات صغيرة مشحونة سالبًا، وأطلق عليها اسم “الإلكترونات“.
كما حسب نسبة الشحنة إلى الكتلة للإلكترونات.
أهمية التجربة: تجربة تومسون كانت هامة بشكل كبير، حيث قدمت دليلاً قاطعاً على وجود الإلكترونات كجسيمات دقيقة وساهمت في تفهم أفضل لبنية الذرة والجسيمات المشحونة والطبيعة الكهرومغناطيسية للمادة.
إعداد التجربة:
أنبوب الأشعة الكاثودية:

إليك بعض الخصائص الرئيسية لأشعة الكاثود:
الشحنة:
أشعة الكاثود تحمل شحنة سالبة.
حددت تجارب ج. تومسون أن أشعة الكاثود تتألف من جسيمات صغيرة مشحونة سالبًا، سماها “الإلكترونات”.
الانحراف بواسطة الحقول الكهربائية:
يمكن أن تتأثر أشعة الكاثود بواسطة الحقول الكهربائية.
عند تطبيق حقل كهربائي عمودي على مسار أشعة الكاثود، تنحني في اتجاه الحقل.
مدى الانحراف يعتمد على قوة واتجاه الحقل الكهربائي.
الانحراف بواسطة الحقول المغناطيسية:
يمكن أيضًا أن تتأثر أشعة الكاثود بواسطة الحقول المغناطيسية.
عند تطبيق حقل مغناطيسي عمودي على مسار أشعة الكاثود، تنحني في مسار دائري أو حلزوني بسبب قوة لورنتز.
مدى الانحراف يعتمد على قوة الحقل المغناطيسي وسرعة الإلكترونات.
حركة مستقيمة:
في حالة عدم وجود قوى خارجية (حقول كهربائية أو مغناطيسية)، تتحرك أشعة الكاثود في خطوط مستقيمة.
تشير هذه السلوك إلى أن الإلكترونات تمتلك الزخم وستستمر في التحرك في حالة عدم وجود قوى.
السرعة:
أشعة الكاثود لديها سرعات عالية، غالبًا نسبة كبيرة من سرعة الضوء.
هذه السرعة العالية هي خاصية للإلكترونات التي تم تسريعها بفارق الجهد الكهربائي داخل أنبوب الأشعة الكاثودية.
توليد الحرارة:
عندما تصطدم أشعة الكاثود بجسم صلب، يمكن أن تولد حرارة بسبب طاقتها الحركية.
تتوفر هذه الخاصية في أنابيب الأشعة الكاثودية (CRTs)، حيث يمكن للشعاع الإلكتروني المركز تحفيز الفوسفور على الشاشة لإنتاج ضوء مرئي أو حرارة.
الاختراق:
تستطيع أشعة الكاثود اختراق المواد الرقيقة وتسبب الاستضاءة.
استُخدمت هذه الخاصية في أنابيب الأشعة الكاثودية الأولى، حيث تصطدم أشعة الكاثود (الإلكترونات) بالهدف المعدني لتوليد أشعة الإكس-راي التي يمكن أن تخترق الجسم البشري لأغراض التصوير الطبي.
نسبة الشحنة إلى الكتلة (e/m):
واحدة من أهم الخصائص لأشعة الكاثود هي نسبة الشحنة إلى الكتلة (e/m).
حددها ج. تومسون في تجاربه، حيث وجد أن هذه النسبة كانت أكبر بكثير من أي جسيم ذري معروف.
هذا الاكتشاف أدى إلى تحديد الإلكترونات كجسيمات نووية دقيقة لها كتلة أصغر بكثير من الذرات.
استقلالية المادة:
تبين أن أشعة الكاثود لديها نفس الخصائص بغض النظر عن المادة المستخدمة للكاثود أو الغاز داخل أنبوب أشعة الكاثود.
هذا يشير إلى أن الخصائص المرصودة كانت متجذرة في الإلكترونات نفسها.
الطبيعة الجسيمية:
أشعة الكاثود تشير سلوكها إلى أنها تتألف من جسيمات منفصلة، وليس مادة مستمرة.
كانت هذه الرؤية حاسمة في تطوير نظرية الذرة وفهمنا للمادة على المستوى الذري والنووي.
دراسة أشعة الكاثود والخصائص التي تظهرها الإلكترونات لعبت دورًا أساسيًا في إعادة تشكيل فهمنا للذرة والجسيمات النووية التي تتكون منها. وقد أدت إلى تطوير النموذج الذري وفيزياء الجسيمات الحديثة.
نموذج تومسون للذرة Thomson s model of the atom
نموذج الذرة لجي. جي. تومسون، المقترح في أواخر القرن التاسع عشر، يشار إليه غالبًا باسم نموذج “الكمثرى بالقمح” أو “الخبز المحشو بالزبيب”.
كانت هذه خطوة هامة في فهمنا لبنية الذرة وكان أول نموذج يضم الجسيمات النووية الدقيقة.
وفيما يلي ملامح النموذج الذري لتومسون:

المادة متجانسة: اعتقد تومسون أن المادة في الذرة متجانسة وأنها تتوزع بالتساوي في جميع أنحائها.
الكهرباء السالبة والموجبة: اقترح أن هناك شحنة سالبة موزعة بشكل متساوي في المادة الموجبة. هذا يعني وجود الإلكترونات (الجسيمات ذات الشحنة السالبة) موزعة في المادة الموجبة كما هو الحال في الكمثرى بالقمح.
مزيد من التجارب: نموذج تومسون جاء نتيجة لتجاربه على الأشعة الكاثودية. هذه التجارب أظهرت وجود الإلكترونات وسمحت له بحساب نسبة شحنتها إلى كتلتها.
نواة موزعة بالتساوي: أفترض تومسون أن هناك نواة إيجابية صغيرة موزعة بالتساوي في المادة الموجبة، مما يعكس فكرة الخبز المحشو بالزبيب.
نموذج تومسون للذرة ساهم في تقدمنا في فهم بنية الذرة وكان النموذج الأول الذي تضمن وجود الإلكترونات كجزء من تكوين الذرة. ومع ذلك، كان هناك تطورات لاحقة في فهم بنية الذرة مع اكتشاف النواة الدقيقة وتطور نماذج ذرية أخرى.
الإلكترونات كجسيمات نووية دقيقة:
من أبرز مساهمات نموذج تومسون كانت اعترافه بوجود الجسيمات النووية الدقيقة، وتحديداً الإلكترونات.
اكتشف الإلكترونات من خلال تجاربه على الأشعة الكاثودية، والتي كانت تيارات من الجسيمات المشحونة سلبياً تُولد في أنبوب فراغي.
شحنة إيجابية متجانسة:
اقترح نموذج تومسون أن الذرة تتكون من “كميثرى” أو “مصفى” إيجابي متجانس عبر حجمها.
اعتقد أن الشحنة الإيجابية كانت موزعة بالتساوي.
الإلكترونات مضمنة في المصفى الإيجابي:
في نموذج تومسون، تم تشتت الإلكترونات، التي كانت تحمل شحنة سالبة، داخل المصفى الإيجابي بشكل مشابه لـ “الكمثرى” في “الكمثرى بالقمح” أو “الزبيب” في “الخبز المحشو بالزبيب”. وكانت الإلكترونات مُمسكة داخل الذرة بفعل القوى التجاذبية بين الشحنات المختلفة.
الذرة متعادلة كهربائياً:
حافظ النموذج على فكرة أن الذرات كانت متعادلة كهربائياً، مما يعني أن الشحنة الإيجابية الإجمالية للمصفى توازنت مع الشحنة السالبة الإجمالية للإلكترونات.
بدون نواة:
على عكس نماذج ذرية لاحقة (مثل نموذج رذرفورد)، لم يتضمن نموذج تومسون نواة مركزية تحتوي على البروتونات. بدلاً من ذلك، اقترح أن الشحنة الإيجابية كانت موزعة بالتساوي.
كان نموذج تومسون ثوريًا بما أنه أدخل مفهوم الجسيمات النووية الدقيقة، وبالأخص الإلكترونات، داخل الذرة.
ومع ذلك، كان لديه بعض القيود. أجريت تجارب لاحقة، وخاصة تجربة رذرفورد برقائق الذهب التي أجراها إرنست رذرفورد، وكشفت عن أن بنية الذرة مختلفة تمامًا عما اقترحه تومسون. عمل رذرفورد أدى إلى تطوير نموذج النواة للذرة، الذي قدم وصفًا أكثر دقة لبنية الذرة، حيث تحتوي على نواة صغيرة وكثيفة تحتوي على البروتونات والنيوترونات في مركز الذرة مع الإلكترونات تدور حولها.
ملخص نموذج تومسون للذرة
نظرية تومسون للذرة، المعروفة أيضًا بنموذج “الكمثرى بالقمح” أو “الكمثرى بالزبيب”، تم اقتراحها في نهاية القرن التاسع عشر.
كانت نموذجًا انتقاليًا مما سمح لأول مرة بتضمين الجسيمات النووية الدقيقة (الإلكترونات) في نظرية ذرية.
استند النموذج إلى عدة فرضيات رئيسية:
1)الذرة مشحونة شحنة موجبة:تومسون افترض أن الذرة تحمل شحنة موجبة موزعة بالتساوي على كل جسيماتها.
2) الإلكترونات مشحونة شحنة سالبة:تومسون اكتشف الإلكترونات من خلال تجارب أشعة الكاثود واعتبرها جسيمات صغيرة مشحونة سالبًا.
الإلكترونات سالبة و مدمجة في الذرة الموجبة: الإلكترونات التي تحمل شحنة سالبة كانت مشتتة داخل الجسم المشحونة إيجابيًا، تمامًا كما لو كانت “الكمثرى بالزبيب”
وفقًا للنموذج، كانت الإلكترونات مدمجة في الذرة بنفس الشكل الذي يشبه “الكمثرى بالزبيب”.
هذه الإلكترونات كانت تملك شحنة سالبة وكانت تمتلك كتلة أصغر بكثير من الذرة.
نموذج تومسون للذرة، المعروف أيضًا بنموذج “الكمثرى بالقمح” أو “الكمثرى بالزبيب”
3)- توزيع الشحنة الموجبة بالتساوي: في نموذج تومسون، اعتبر الذرة ككرة محملة بشحنات موجبة تم توزيع الشحنة الموجبة بالتساوي عبر حجم الذرة. كان يتم التشبيه في الغالب بتلك الشحنة الموجبة بـ “الكمثرى” أو “المصفرة”. هذه الشحنة الموجبة تعمل كموازن لشحنة الإلكترونات السالبة.
4- الكهرباء العدمية: أحتفظ نموذج تومسون بفكرة أن الذرة كهربائيًا متعادلة. حيث تعوض الشحنة الإيجابية الإجمالية للمصفرة مع الشحنة السالبة الإجمالية للإلكترونات، مما يضمن تواجد ذرة متعادلة كهربائيًا.
5- حفظ الكتلة والحجم: توافق نموذج تومسون مع مبدأ حفظ الكتلة، مما يعني أن الكتلة الإجمالية للذرة تظل ثابتة خلال التفاعلات الكيميائية. علاوة على ذلك، افترض أن حجم الذرة يكون تقريبًا نفس حجم الذرة بالإجمال.
نموذج إرنست رذرفورد للذرة
Rutherford ‘s model of the atom
Rutherford s experiment: the gold foil experiment
تجربة إرنست رذرفورد الشهيرة، والمعروفة بتجربة “صفيحة الذهب”، أُجريت في عام 1909 ولعبت دورًا حاسمًا في إعادة تشكيل فهمنا لبنية الذرة. كانت الهدف الرئيسي لتلك التجربة هو دراسة بنية الذرات، وبالتحديد توزيع الشحنة داخل الذرة وطبيعة النواة الذرية.
الهدف:
الهدف الرئيسي لتجربة إرنست رذرفورد كان دراسة بنية الذرة، وبالأخص توزيع الشحنة داخل الذرة وطبيعة النواة الذرية.
مكونات التجربة:
المصدر: تم استخدام صندوق من الرصاص به مصدر مشع لجسيمات ألفا (النواة المشحونة إيجابيًا) لإطلاق تلك الجسيمات نحو العينة.
العينة: تم استخدام عينة من رقائق الذهب شديدة الرقة.
شاشة: وضعت شاشة مصنوعة من مادة ذات خواص مثل الفسفور تضيء عند تعرضها للجسيمات الألفا.
جهاز كشف: تم وضع جهاز كشف خلف الشاشة لرصد أي جسيمات ألفا تمر خلال الشاشة وتصيب الجهاز.

سير التجربة:
تم إطلاق الجسيمات ألفا نحو عينة الذهب الرقيقة. وفقًا لنموذج رذرفورد، كان من المتوقع أن تمر معظم الجسيمات ألفا بسلاسة خلال الذهب نظرًا لأنه كان من المفترض أن تكون الشحنة الموجبة موزعة بالتساوي في الذرات.
النتائج المفاجئة:
ومع ذلك، شُغل رذرفورد واحدة من أكبر المفاجآت في تاريخ العلم عندما لاحظ أن بعض الجسيمات الألفا عادت إليه بزوايا كبيرة ولم تمر بسلاسة. هذا يشير إلى وجود نواة صغيرة وكثيفة في مركز الذرة تحتوي على الشحنة الموجبة.
هذا التفسير الجديد لبنية الذرة يمكن تلخيصه بأن الذرة معظمها مساحة فارغة مع نواة مركزية صغيرة تحمل الشحنة الموجبة.
تأثير التجربة:
تأثرت تلك التجربة بشكل كبير على نماذج الذرات والفهم الحديث للبنية الذرية. أعطت دلائل قوية على وجود نواة في الذرة وغيّرت تمامًا النموذج القديم الذي افترض توزيعًا متجانسًا للشحنة داخل الذرة. هذا الا
الإعداد التجريبي:
جزيئات ألفا: استخدم رذرفورد مصدرًا لجزيئات ألفا، وهي نوى الهيليوم (مكونة من اثنين من البروتونات واثنين من النيوترونات). هذه الجزيئات ألفا كانت مشحونة إيجابياً ومشحونة بشكل عالي.
غشاء ذهبي: تم استخدام ورقة ذهبية رقيقة جداً، تحتوي على عدد قليل من الذرات فقط، كهدف. تم اختيار ورقة الذهب لقابليتها للتشكيل، مما سمح باستخدامها بشكل رقيق جداً.
شاشة متلألئة: وراء ورقة الذهب، وضع رذرفورد شاشة متلألئة تستطيع اكتشاف مرور جزيئات ألفا وإصدار وميضات من الضوء عند اصطدامها بجزيئات ألفا.
الملاحظات والاستنتاجات الرئيسية:
التوقع: توقع رذرفورد أن جزيئات ألفا، التي تحمل شحنة إيجابية، ستتم توجيهها بشكل طفيف أثناء مرورها من خلال ورقة الذهب. وهذا كان متوافقًا مع النموذج السائد في ذلك الوقت، نموذج تومسون، الذي اقترح أن الشحنة الإيجابية في الذرة موزعة بشكل متساوي في جميع أنحاء الذرة.
النتائج: إلا أن النتائج التجريبية كانت مفاجئة. مرت معظم جزيئات ألفا خلال ورقة الذهب بتوجيه بسيط، كما كان متوقعًا. ولكن جزء صغير من جزيئات ألفا تم حيدودها بزوايا كبيرة، وبعضها حتى ارتدت باتجاه المصدر.
تجربة رذرفورد ونموذجه النووي للذرة كانت تحولًا هامًا عن النماذج الذرية السابقة وقدمت أول أدلة تجريبية على وجود نواة صغيرة ومشحونة إيجابياً في وسط الذرة.
هذه التجربة قامت بإعادة تشكيل فهمنا للبنية الذرية ووضعت الأسس لنظرية الذرة الحديثة.
إجراء تجربة رذرفورد
إعداد التجربة:
قام رذرفورد بإعداد جميع أدوات التجربة في بيئة مراقبة، مضمناً تقليل إشعاع الخلفية للحصول على نتائج دقيقة.
قذف ورقة الذهب:
توجهت جزيئات ألفا التي نبعث من المصدر الإشعاعي نحو ورقة الذهب.
تم تسريعها إلى سرعات عالية باستخدام حقل كهربائي.
مراقبة تبديد الجزيئات ألفا:
مرت الجزيئات ألفا واصطدمت بذرات الذهب أثناء مرورها من خلال ورقة الذهب.
رصد رذرفورد وفريقه نمط تبديد الجزيئات ألفا بواسطة الشاشة المتلألئة. تم ذلك في غرفة مظلمة لجعل وميض الضوء أكثر وضوحًا.
جمع البيانات:
جمع رذرفورد وفريقه البيانات حول الزوايا التي تم تبديد الجزيئات ألفا عندها.
سجلوا عدد الجزيئات ألفا التي لم يتم تبديدها والتي تم تبديدها قليلاً أو تبديدها بشكل كبير، والتي ارتدت حتى اتجهت بالعكس نحو المصدر.
تحليل النتائج:
بعد القيام بجمع البيانات، قام رذرفورد بتحليل النتائج ووجد أن نتائج التجربة كانت مدهشة ومتغيرة عن توقعاته.
بينما مرت معظم جزيئات ألفا من خلال ورقة الذهب بدون تبديد يُذكر، إلا أن جزء صغير جداً من الجزيئات ألفا تعرض لتبديد كبير وبعضها انعكس حتى اتجه بالعكس نحو المصدر. هذه النتائج كانت معارضة تماماً للنموذج المقبول حينذاك، نموذج ثومسون، الذي اقترح أن الشحنة الإيجابية في الذرة موزعة بشكل موحد.
استنتج رذرفورد من هذه النتائج أن معظم كتلة الذرة وشحنتها الإيجابية متركزة في نواة صغيرة وكثيفة في وسط الذرة. هذه النواة كانت محاطة بمعظم الفراغ في الذرة، والإلكترونات كانت تدور حولها. تم تفسير تبديد وتشتت الجزيئات ألفا بالتفاعل مع النواة.
وبهذا الاكتشاف الريادي، قدم رذرفورد نموذجاً جديداً للذرة يعكس هذه الهيكلية. هذا الاكتشاف الذي أجراه رذرفورد وفريقه في تجربة ورقة الذهب كان يعتبر بمثابة نقطة تحول كبيرة في مفهومنا لهيكل الذرة ووضع أسس النظريات الذرية الحديثة.
تحليل النتائج:
قام رذرفورد بتحليل نتائج التجربة، مشيرًا إلى أن معظم جزيئات ألفا انتقلت من خلال ورقة الذهب دون تبديل كبير، ولكن جزء صغير تعرض لتبديل كبير وبعضها حتى عاد باتجاه المصدر.
بناءً على النتائج المدهشة للتجربة، استنتج رذرفورد ما يلي:
-
معظم كتلة الذرة وشحنتها الإيجابية كانت متركزة في نواة صغيرة وكثيفة في وسط الذرة.
قدم نموذج ذري جديد حيث تدور الإلكترونات حول النواة في معظم الفراغ. هذا كان تحولا عن النموذج السائد في ذلك الوقت، نموذج ثومسون.
أعطى تجربة ورقة الذهب لرذرفورد دليلا تجريبيا على وجود النواة الذرية، مما أسهم في تشكيل فهمنا لهيكل الذرة وأدى إلى تطوير نموذج النواة الذرية.
كانت هذه التجربة اكتشافًا رائدًا ووضعت الأسس للنظرية الذرية الحديثة.
-
تجربة رذرفورد: الملاحظة ، التفسير ثم الاستنتاجات
الملاحظات:
في تجربة الذهب لإرنست رذرفورد، تمت الملاحظات التالية:
مرت معظم جزيئات ألفا من خلال ورقة الذهب بقليل أو بدون تبديل. استمروا في اتجاههم الأصلي.
تم تبديل بعض جزيئات ألفا قليلاً عن مسارها الأصلي أثناء مرورها من خلال ورقة الذهب.
تعرضت جزء صغير من جزيئات ألفا لتبديل كبير، حيث انحرفت بشكل كبير عن مسارها الأصلي.
قليل جداً من جزيئات ألفا (تقريباً 1 من كل 8000) عادت باتجاه المصدر، مبتعدة بفعالية عن الاتجاه الذي تم توجيهها إليه أولاً.
-
التفسير:
تم تفسير نتائج تجربة رذرفورد كالتالي:
- معظمها فراغ: حقيقة مرور معظم جزيئات ألفا من خلال ورقة الذهب بقليل أو بدون تبديل دلت على أن الذرة تحتوي على الكثير من الفراغ.
أشار ذلك إلى أن الشحنات الإيجابية في الذرة متركزة في منطقة مركزية صغيرة.
تركيز الشحنة الإيجابية:
-تم تصدير بعض تبديل الجزيئات ألفا والحالات النادرة لتبديل كبير إلى التفاعل مع النواة الإيجابية للذرة.
تسبب تركيز الشحنة الإيجابية في النواة الإلكترونات الإيجابية في الانبعاث أو التبديل.
الجزيئات ألفا التي عادت إلى الوراء:
-أكثر الملاحظات إذهالًا كانت قليلًا جدًا من جزيئات ألفا التي عادت باتجاه المصدر.
دل ذلك على أنها صادفت شحنة إيجابية مركزة للغاية عند أقرب نقطة، مما تسبب في اندفاع قوي.
اشتمل ذلك على أن النواة صغيرة للغاية ومكتظة بالشحنة الإيجابية.
-
الاستنتاجات:
بناءً على هذه الملاحظات والتفسيرات، استخلص رذرفورد العديد من الاستنتاجات الرئيسية:
الذرة تحتوي على الكثير من الفراغ: معظم حجم الذرة يتكون من الفراغ الذي يمكن لجزيئات ألفا المرور من خلاله بدون تفاعل كبير.
شحنة إيجابية متركزة: الذرة تحتوي على نواة صغيرة وكثيفة ومشحونة إيجابيًا في وسطها. هذه النواة مسؤولة عن تبديل وتشتت جزيئات ألفا.
الإلكترونات مشحونة سلبًا: الإلكترونات تدور حول النواة في الفراغ بشكل رئيسي. شحنتها السلبية تتوازن مع شحنة النواة الإيجابية، مما يضمن أن الذرة كلها محايدة كهربائيًا.
نموذج ذري معدل: أدى اكتشاف رذرفورد إلى تطوير نموذج النواة للذرة، حيث النواة هي قلب صغير ومتجانس يحتوي على البروتونات والنيوترونات، بينما تدور الإلكترونات في مستويات الطاقة المحددة أو المدارات حول النواة.
ملخص افتراضات راذارفور للذرة
نموذج النواة: استنتج رذرفورد من تفسيره لهذه النتائج وجود نموذج جديد للذرة. أوضح أن معظم كتلة الذرة وشحنتها الإيجابية تتمركز في نواة صغيرة ومكثفة في وسط الذرة. وهذه النواة تحيط بها معظم الفراغ، حيث تتداول الإلكترونات حولها.
نموذج إرنست رذرفورد للذرة، والمعروف أيضًا بنموذج “النواة” أو “نموذج رذرفورد”، تم اقتراحه في بداية القرن العشرين وكان تقدمًا كبيرًا في فهمنا لبنية الذرة. إليك أهم ملامح نموذج راذرفور:
-
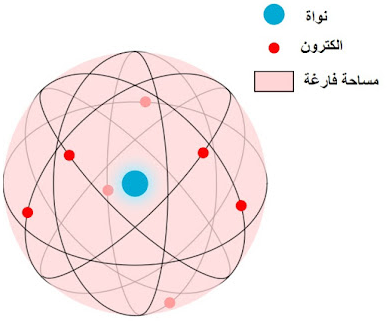
نموذج ذرة رازرفورد -
-النواة النووية: افترض نموذج رذرفورد أن الذرة تحتوي على نواة صغيرة وكثيفة تحمل شحنة إيجابية في مركزها. تحتوي هذه النواة على معظم كتلة الذرة وتكون مسؤولة عن الشحنة الإيجابية للذرة.
-الإلكترونات في مدار: حول النواة، اقترح رذرفورد أن الإلكترونات تدور حول النواة في مسارات معينة وجيدة التعريف أو مدارات. كان يتم التشبيه غالبًا بهذه المدارات بالطريقة التي تدور بها الكواكب حول الشمس في نظام شمسي.
-الإلكترونات ذات شحنة سالبة: الإلكترونات في نموذج رذرفورد كانت تحمل شحنة سالبة وكانت مجذبة نحو النواة المشحونة إيجابيًا بسبب القوة الكهروستاتية للجذب.
-المساحة الفارغة: اقترح نموذج رذرفورد أن معظم حجم الذرة هو مساحة فارغة. النواة كانت صغيرة جدًا بالمقارنة مع حجم الذرة، والإلكترونات احتلت معظم هذه المساحة.
-ذرة كهربائياً متعادلة: الذرة ككل ظلت كهربائياً متعادلة. الشحنة الإيجابية للنواة توازن الشحنة السالبة للإلكترونات، مما يؤدي إلى ذرة متعادلة كهربائيًا بشكل عام.
-مدارات كوكبية: غالبًا ما تم التشبيه بنموذج رذرفورد ببنية نظام شمسي، حيث النواة كالشمس والإلكترونات كالكواكب في مدارات دائرية ثابتة. ومع ذلك، تم تعديل هذا الجانب لاحقًا مع تطور الميكانيكا الكمية لشرح سلوك الإلكترونات بشكل أكثر دقة.
نموذج رذرفورد كان تقدمًا كبيرًا في تطور نظريات الذرة ولكن تم تحسينه وتوسيعه لاحقًا مع ظهور الميكانيكا الكمية في بداية القرن العشرين. الميكانيكا الكمية قدمت وصفًا أدق لسلوك الإلكترونات داخل الذرة، متحركة بعيدًا عن الفكرة التقليدية للإلكترونات تتبع مسارات دائرية ثابتة وقدمت مفهوم توزيعات احتمال الإلكترونات في المدارات.
