أنواع الخلايا الجلفانية
أنواع الخلايا الجلفانية
ما هي أنواع الخلايا الجلفانية؟ تنقسم الخلايا الجلفانية حسب طبيعة عملها لإنتاج الطاقة الكهربية إلى نوعين :
1- خلايا أولية ب- خلايا ثانوية
أولاً : الخلايا الأوليــــة
الخلايا الأولية :هى أنظمة تختزن الطاقة فى صورة كيميائية يمكن تحويلها إلى طاقة كهربية من خلال تفاعل أكسدة واختزال تلقائى غير انعكاسى
خصائصها :
1- لا يسهل ( من المستحيل ) إعادة شحنها لأنها غير انعكاسية .
2- تكون فى صورة جافة ليست سائلة ليسهل استخدامها فى الأجهزة المتنقلة ( لذلك تسمى البطاريات الجافة )
3- تحقق جهداً ثابتاً لمدة طويلة أثناء تشغيلها ويمكن تصنيعها فى أحجام صغيرة .
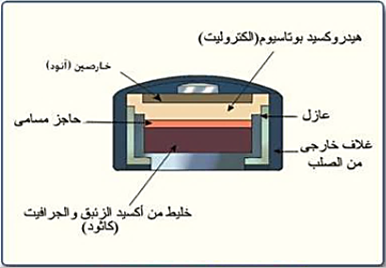
خليــــــــة الزئبق:
– تصنع فى شكل اسطوانى أو على هيئة قرص وتتكون من :
1- قطب سالب من الخارصين .
2- قطب موجب من أكسيد الزئبق .
3- إلكتروليت هيدروكسيد بوتاسيوم .
التفاعل الكلى الحادث فى هذه الخلية هو :

مميزاتها :
1- صغيرة الحجم .
2- تعطى قوة دافعة = 1.35 فولت
استخداماتها : تستخدم فى سماعات الأذن والساعات وآلات التصوير .
– يجب التخلص من هذه البطارية بطريقة آمنة بعد استخدامها لأنها تحتوى على الزئبق وهو مادة سامة .
خليــــــــة الوقود
– الهيدروجين يحترق فى الهواء بعنف وينتج عن عملية الاحتراق ضوء وحرارة
2H2(g) + O2(g) → 2H2O(v) +Energy
– تمكن العلماء من إجراء هذا التفاعل تحت ظروف يتم فيها داخل ما يعرف بخلية الوقود
– هذا النوع من الخلايا يجد اهتماماً بالغاً فى مركبات الفضاء حيث أن الوقود الغازى من الهيدروجين والأكسجين المستخدم فى إطلاق الصواريخ هو نفسه الوقود المستخدم فى هذا التفاعل
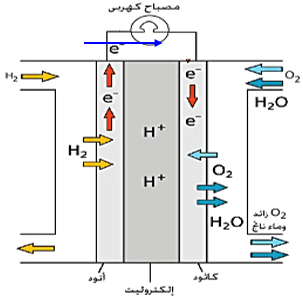
تركيب الخلية :
– قطبين كل منهما على شكل وعاء مجوف مبطن بطبقة من الكربون المسامى تسمح بالاتصال بين الحجرة الداخلية والمحلول الإلكتروليتى الموجود بها وهو غالباً محلول هيدروكسيد البوتاسيوم المائى
التفاعلات الحادثة فى الخلية:
تفاعل الأكسدة
2H2(g)+ 4OH − (g) → 4H2O(v) + 4e – Eo = 0.83 V ( oxidation )
تفاعل الاختزال
O2(g) + 2H2O(v)+ 4e – → 4OH −(g) Eo = 0.4 V ( reduction )
التفاعل الكلى الحادث :
2H2(g) + O2(g) → 2H2O(v) Ecell = 1.23 V
ملاحظات هامة:
1- خلية الوقود لا تستهلك مثل باقى الخلايا الجلفانية : لأنها تزود بالوقود من مصدر خارجى
2- تعطى قوة دافعة كهربية Ecell =1.23 V
3- تعمل خلية الوقود عند درجة حرارة عالية فيتبخر الماء ويمكن إعادة تكثيفه للاستفادة منه كمياه للشرب لرواد الفضاء
4- على عكس الخلايا الأخرى نجد أن خلايا الوقود لا تختزن الطاقة لأن عملها يتطلب إمدادها المستمر بالوقود وإزالة مستمرة للنواتج
تدريب
علل؟
1- الخلايا الأولية خلايا غير انعكاسية
لأنه لا يمكن إعادة شحنها بعد تفريغها
2-تكون الخلايا الأولية غالباً فى صورة جافة وليست سائلة
لأن الصورة الجافة تحقق جهداً ثابتاً لمدة أطول أثناء التشغيل بالإضافة إلى إمكانية تصنيعها في حجم صغير يسهل استخدامها
3- تعتبر خلية الزئبق من الخلايا الجلفانية الأولية
خلية جلفانية لأنها تنتج طاقة كهربية من خلال تفاعل أكسدة واختزال تلقائى ، وخلية أولية لأن تفاعلاتها الكيميائية غير انعكاسية لا يمكن إعادة شحنها
4- يلزم التخلص من خلية الزئبق بعد استخدامها.
لاحتوائها على مادة الزئبق السامة
5- قطبى خلية الوقود مبطنين بطبقة من الكربون المسامى
لكى تسمح بالاتصال بين مكونات الوعاء المجوف والمحلول الإلكتروليتى
6- تلعب خلية الوقود دوراً هاماً ً فى مركبات الفضاء
لأن الوقود الغازى من الهيدروجين والأكسجين المستخدم فيها هو نفس الوقود المستخدم فى إطلاق صواريخ الفضاء ، بالإضافة إلى إمكانية الاستفادة من بخار الماء الناتج عنها ” بعد تكثيفه ‟ كمياه للشرب
ثانياً : الخلايا الثانويــــة
هى خلايا جلفانية تختزن الطاقة الكهربية على هيئة طاقة كيميائية يمكن تحويلها مرة أخرى إلى طاقة كهربية وتفاعلاتها الكيميائية تفاعلات انعكاسية .
– يمكن إعادة شحنها وذلك بإمرار تيار كهربى ( من مصدر خارجى ) بين قطبيها فى اتجاه عكس عملية التفريغ
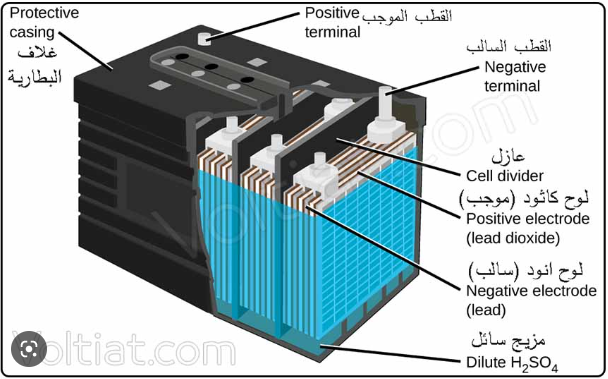
بطارية الرصاص الحامضية ( بطارية السيارة )
التركيب :
1- وعاء خارجى : مصنوع من المطاط الصلب أو من البلاستيك ( بولى ستيرين ) الذى لا يتأثر بالأحماض
2- ستة خلايا موصلة على التوالى : كل خلية تنتج 2 فولت
3- المصعد ( الآنود ) : عبارة عن شبكة من الرصاص مملوءة برصاص اسفنجى
3- المهبط ( الكاثود ) : عبارة عن شبكة من الرصاص مملوءة بعجينة من ثانى أكسيد الرصاص .
4- تفصل الألواح عن بعضها بصفائح عازلة .
5- تغمر الألواح كلها فى حمض كبريتيك مخفف الذى يعمل كسائل التوصيل الكهربى ( إلكتروليت )
6- تعمل البطارية كخلية جلفانية أثناء تشغيلها ( تفريغها ) واستهلاك طاقتها ، أما عند إعادة شحنها تعمل كخلية إلكتروليتية
التفاعلات التى تحدث داخل المركم :
أ- عند تشغيل البطارية تحدث التفاعلات الآتية :
1- تفاعل الآنود ( المصعد )
Pb(s) + SO4-2(aq)→ PbSO4(s) + 2e– Eo = 0.36 V
جهد التأكسد القياسى لهذا التفاعل = 0.36 V
2- عند الكاثود ( القطب الموجب )
PbO2(s) + 4H+(aq) + SO4(aq)-2 + 2e– → PbSO4+ 2H2O(ℓ) Eo = 1.69 V
وجهد الاختزال القياسى لهذا التفاعل = 1.69 V
3- وعند التفريغ تكون معادلة التفاعل الكلى للبطارية :
Pb(s) + PbO2(s) + 4H+(aq) + 2SO4-2(aq) discharge →2PbSO4(s) + 2H2O(ℓ) Ecell =2.05 V
ويعتبر هذا التفاعل تلقائى وتعمل البطارية فى هذه الحالة كخلية جلفانية .
تفاعل شحن البطارية
– عند استعمال البطارية لفترة طويلة يقل تركيز حمض الكبريتيك نتيجة زيادة كمية الماء الناتجة من التفاعلات الحادثة وتحول مواد الكاثودPb والآنود PbO2 إلى كبريتات رصاص II
– نتيجة لذلك تقل كمية التيار الناتجة من البطارية وتحتاج لإعادة الشحن .
كيف يمكن إعادة شحن المركم :
– يوصل المركم بمصدر كهربى خارجى له جهد أكبر قليلاً من الجهد الذى ينتج عن المركم
– يؤدى ذلك إلى انعكاس التفاعلات التى تحدث عند الأقطاب فتتحول كبريتات الرصاص إلى رصاص وثانى أكسيد الرصاص ويعود تركيز الحمض إلى ما كان عليه قبل التفريغ
ملاحظات هامة:
يتم التعرف على حالة البطارية عن طريق قياس كثافة محلول الحمض بواسطة الهيدرومتر ( مقياس الكثافة للسوائل ) : حينما تكون البطارية كاملة الشحن تكون كثافة الحمض فيها من cm3 / 1.28 gm إلى cm3 / 1.3 gm ، وعندما تقل كثافة الحمض عن cm3 / 1.2 gm يدل ذلك على أن البطارية تحتاج إلى إعادة الشحن وزيادة تركيز الحمض فيها .
2PbSO4(s)+2H2O(ℓ) charge → Pb(s) +PbO2(s)+4H+(aq) + 2SO4-2(aq)
أثناء الشحن تعمل البطارية كخلية إلكتروليتية : حيث يتم فيها إحداث تفاعل كيميائى غير تلقائى بواسطة مرور تيار كهربى ( ذلك يعنى تخزين الطاقة الكهربية الواردة من المصدر الخارجى فى شكل طاقة كيميائية ) ، لذلك تعتبر الخلايا الثانوية ( المراكم ) بطاريات لتخزين الطاقة .
فى السيارة يستخدم الدينامو بصورة مستمرة فى إعادة شحن البطارية أولاً بأول .
بطارية أيون الليثيوم
– تعتبر بطارية أيون الليثيوم الجافة من البطاريات القابلة لإعادة الشحن
الاستخدام :
تستخدم فى أجهزة التليفون المحمول والكمبيوتر المحمول ( اللاب توب )
فى بعض السيارات الحديثة كبديل لبطارية المركم الرصاصى : لخفة وزنها وقدرتها على تخزين كميات كبيرة من الطاقة بالنسبة لحجمها
ملحوظة يستخدم الليثيوم فى هذه البطارية بسبب :
1- أنه أخف فلز معروف
2- جهد اختزاله القياسى هو الأصغر بالنسبة لباقى الفلزات الأخرى ( – 3.04 V )
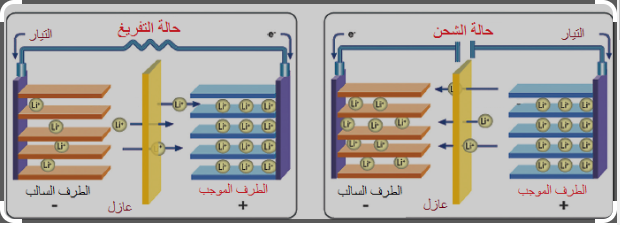
تركيب البطارية :
يحتوى الغلاف المعدنى للبطارية على 3 رقائق ملفوفة بشكل حلزونى :
1- الإلكترود الموجب ( الكاثود ) ويتكون من أكسيد الليثيوم كوبلت ( LiCoO2 )
2- الإلكترود السالب ( الآنود ) ويتكون من جرافيت الليثيوم ( LiC6 )
3- العازل وهو مكون من شريحة رقيقة جداً من البلاستيك تعمل على عزل الإلكترود الموجب عن السالب
4- تغمر الرقائق الثلاثة فى إلكتروليت لا مائى من سداسى فلوروفوسفيد الليثيوم ( LiPF6 )
عند تشغيل البطارية تحدث التفاعلات التالية :
تفاعل الآنود : –LiC6(s) → C6(s) + Li+(aq) + e
تفاعل الكاثود: CoO2(s) + Li+(aq) + e– → LiCoO2(s)
تعطى هذه الخلية قوة دافعة كهربية Ecell = 3 V
والتفاعل الكلى الحادث هو :
![]()
تدريب
علل:1- بطارية الرصاص الحامضية من الخلايا الجلفانية الثانوية
خلية جلفانية لأنها تنتج طاقة كهربية من خلال تفاعل أكسدة واختزال، وخلية ثانوية لأن تفاعلاتها الكيميائية انعكاسية يمكن إعادة شحنها
2- يؤدى طول استعمال البطارية إلى خفض تركيز حمض الكبريتيك المركز
لزيادة كمية الماء الناتج عن تفاعل التفريغ
3- خلية الزئبق قلوية بينما بطارية الرصاص حامضية
لأن المحلول الإلكتروليتى في بطارية الزئبق هو هيدروكسيد البوتاسيوم ( القلوى )بينما في بطارية الرصاص هو حمض الكبريتيك
4- تعتبر بطارية السيارة خلية انعكاسية .
لأنه إذا تم إمداد الخلية بمصدر كهربى خارجى للتيار المستمر جهده أكبر قليلاً من الجهد الناتج منها فإن التفاعل التلقائى الذى يحدث بداخلها ينعكس ويتحول تفاعل الأكسدة إلى اختزال وتفاعل الاختزال إلى أكسدة
5- تعتبر الخلايا الثانوية ( المراكم ) بطاريات لتحزين الطاقة
لأنه أثناء شحنها تعمل كخلايا إلكتروليتية يتم فيها تخزين الطاقة الكهربية الواردة من المصدر الخارجى فى صورة طاقة كيميائية
6- استخدام بطارية السيارة لمدة طويلة يؤدى إلى نقص كمية التيار الناتج عنها
بسبب خفض تركيز حمض الكبريتيك وتحول مواد الآنود والكاثود إلى كبريتات الرصاص II
7- يجب إعادة شحن بطارية السيارة من وقت لآخر .
لأن طول مدة استعمال البطارية يؤدى إلى ضعف حمض الكبريتيك الموجود بها نتيجة لاستهلاكه وزيادة كمية الماء نتيجة تكونه فى التفاعل مما يؤدى إلى نقص كمية التيار الناتجة عنها وتحتاج إلى إعادة الشحن
8- يعمل المركم الرصاصى عند إعادة الشحن كخلية إلكتروليتية .
لأن تفاعل الشحن يعتبر تفاعل غير تلقائى يحتاج إلى فرق جهد خارجى .
9- يستخدم الليثيوم في تركيب بطارية ايون الليثيوم
لأنه أخف فلز معروف بالإضافة إلى ان جهد اختزاله القياسى هو الأصغر بالنسبة لباقى العناصر
10- تستخدم بطاريات أيون الليثيوم كبديل لمركم الرصاص في السيارات الكهربية الحديثة
لخفة وزنها وقدرتها على تخزين كميات كبيرة من الطاقة مقارنة بحجمها
