الخلايا الإلكتروليتية – قوانين فراداي للتحليل الكهربي
ما هي الخلايا الإلكتروليتية؟
الخلايا الإلكتروليتية هى خلايا كهربية تستخدم فيها طاقة كهربية من مصدر خارجى لإحداث تفاعل أكسدة واختزال غير تلقائى .
تكوين الخلايا الإلكتروليتية

1- إناء يحتوى على محلول إلكتروليتى قد يكون :
أ- محلول لأحد الأحماض أو القواعد أو الأملاح
ب- مصهور لأحد الأملاح .
– يغمر بالمحلول قطبان مصنوعان من :
أ- من مادة واحدة ( مثل الكربون أو البلاتين )
ب- من مادتين مختلفتين ( مثل الكربون ــ البلاتين ــ النحاس ــ الخارصين ــ أو غيرها …… )
3- يوصل أحد القطبين بالقطب الموجب للبطارية ليصبح قطباً موجب الشحنة ( آنود ) وتحدث عنده تفاعلات أكسدة .
4- يوصل القطب الثانى بالقطب السالب للبطارية ( كاثود ) وتحدث عنده تفاعلات اختزال .
خطوات العمل :
1- عند توصيل القطبين ( بحيث يكون الجهد الواقع على الخلية يفوق قليلاً الجهد الانعكاسى للخلية ) يسرى تيار كهربى
2- نتيجة لسريان التيار الكهربى تتجه الأيونات الموجبة من المحلول نحو القطب السالب ( الكاثود ) وتعادل شحنتها باكتساب إلكترونات ( اختزال ) ، بينما تتجه الأيونات السالبة من المحلول نحو القطب الموجب ( الآنود ) وتعادل شحنتها بفقد إلكترونات ( أكسدة )
3- تفاعل الأكسدة والاختزال الذى يحدث فى الخلية أثناء التحليل هو تفاعل غير تلقائى حيث أنه لا يحدث إلا بتأثير الطاقة الخارجة من البطارية .
ملحوظة
الإلكتروليتات المستخدمة كموصلات فى هذه الخلايا تختلف عن الموصلات الإلكترونية ( الفلزات )
– الإلكتروليتات السائلة نوعان :
أ- محاليل الأحماض والقواعد والأملاح
ب- مصهور الأملاح
مثال : التحليل الكهربى لمحلول كلوريد النحاس ( CuCl2 )
تفاعلات الأكسدة والاختزال التالية سوف تحدث فى الخلية الإلكتروليتية
جهد الأكسدة = 1.36ــ فولت
أ- عند المصعد ( الآنود ) وهو القطب الموجب
جهد الأكسدة = 1.36ــ فولت
– 2Cl– → Cl2 + 2e
ب- عند المهبط ( الكاثود ) وهو القطب السالب
Cu+2 + 2e– → Cuo
جهد الاختزال = 0.34 + فولت
ويكون التفاعل الكلى الحادث فى الخلية هو مجموع تفاعلى الآنود والكاثود

وجهد الخلية = مجموع جهدى الأكسدة والاختزال لنصفى الخلية
V 1.02ــ = 0.34 + 1.36ــ =emf
ملحوظة الإشارة السالبة لجهد الخلية تعنى أن التفاعل الكلى الحادث فى الخلية لا يتم تلقائياً إذا كان فى
خلية جلفانية ولكن يتم فى خلية إلكتروليتية باستخدام طاقة كهربية من مصدر خارجى .
– يطلق على مثل هذه العملية التى تم فيها فصل مكونات المحلول الإلكتروليتى ( مثل ترسب النحاس وتصاعد الكلور ) إسم التحليل الكهربى .
التحليل الكهربى
هو التحلل الكيميائى للمحلول الإلكتروليتى بفعل مرور التيار الكهربى فيه
ملاحظات هامة
يمكن الحصول على غاز الكلور بالتحليل الكهربى للمحاليل المائية التى تحتوى على أيون الكلوريد
بسبب أكسدة ايونات الكلوريد عند الآنود مكونة غاز الكلور
يعتبر الآنود هو القطب الموجب والكاثود هو القطب السالب فى الخلية التحليلية .
لاتصال الآنود بالقطب الموجب الكهربى و تحدث عنده عملية أكسدة وتتحرر عنده الإلكترونات والكاثود بالقطب السالب للمصدر
النحاس موصل إلكترونى بينما كبريتات النحاس موصل إلكتروليتى : لأن النحاس فلز يوصل التيار عن طريق حركة الإلكترونات فى المستوى الأخير بينما كبريتات النحاس محلولها متأين ويتم توصيل التيار بسبب حركة الأيونات إلى الأقطاب المخالفة لها فى الشحنة .
قوانين فاراداى للتحليل الكهربى
قانون فاراداى الأول :
تتناسب كمية المادة المتكونة أو المستهلكة عند أى قطب سواء كانت غازية أو صلبة تناسباً طردياً مع كمية الكهرباء التى تمر فى المحلول الإلكتروليتى .
قانون فاراداى الثانى :
كتلة المواد المتكونة أو المستهلكة بمرور نفس كمية الكهرباء تتناسب طردياً مع كتلتها المكافئة .
يمكن تحقيق قانون فاراداى الأول كالتالى :
– بإمرار كميات مختلفة من التيار فى نفس المحلول وتعيين كتل المواد المتكونة أو المستهلكة عند الأقطاب نجد أنها تتناسب طردياً مع كمية التيار المادة فى المحلول
تحقيق القانون الثانى لفاراداى

الخطوات :
– نمرر نفس كمية التيار الكهربى فى محاليل مختلفة مثل محلول كبريتات النحاس ، محلول نترات الفضة ، محلول كلوريد الألومنيوم ومتصلة على التوالى .
المشاهدة :
– نلاحظ أن كتل المواد المتكونة على الكاثود فى كل خلية هى النحاس والفضة والألومنيوم تتناسب مع الكتل المكافئة لهذه المواد أى بنسبة 9 : 107.88 : 31.75
∴ عند إمرار كمية كهربية قدرها 1C فى محلول أيونات فضة يتم ترسيب 1.118 mg من الفضة ( 0.001118 g )
الفاراداى ( F ) : هو كمية التيار الكهربى اللازمة لترسيب أو إذابة الكتلة المكافئة الجرامية لأى عنصر
1 فاراداى = 96500 كولوم
القانون العام للتحليل الكهربى : عند إمرار فاراداى (96500 كولوم ) خلال إلكتروليت فإن ذلك يؤدى إلى ذوبان أو ترسيب أو تصاعد كتلة مكافئة جرامية من المادة عند أحد الأقطاب
ملحوظة
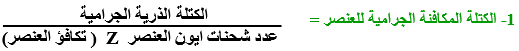
الكتلة المكافئة الجرامية
هى كتلة المادة التى لها القدرة على فقد أو اكتساب مول واحد من الإلكترونات أثناء التفاعل الكيميائى
حساب كتلة المادة المترسبة بالجرام

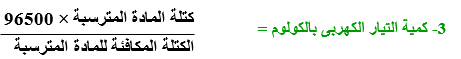
– كمية التيار الكهربى ( كولوم ) = شدة التيار ( ت ) × الزمن بالثوانى ( ز )
4- عدد وحدات الفاراداى اللازمة لترسيب atom/ gm من المادة = الفاراداى × التكافؤ (Z )
أى أن : كمية الكهرباء اللازمة لترسيب atom/ gm من الفضة من التفاعل
Ag+ → Ag
F × 1 = F
– بينما كمية الكهرباء اللازمة لترسيب atom/ gm من النحاس من التفاعل
Cu+2 → Cu
= F × 2 = 2
قانون فراداي الثاني
يعبر عن قانون فراداي الثاني:

